
Рак желудка отличает неравномерность распространения как в разных странах, так и отдельных регионах. Относительно редко- он регистрируется в США, странах экваториальной Африки, часто — в Японии и СССР. Несмотря на повсеместное снижение заболеваемости раком желудка, для СССР эта проблема остается одной из главных. Сложность ее состоит в том, что почти у 3 и* 4 первично выявленных больных заболевание регистрируется в. III—IV стадии, когда нет возможности применить радикальные- методы лечения.
В последние годы отмечено улучшение диагностики начальных стадий рака желудка, в которых операция приводит к стойкому выздоровлению. R. A. Gutmann (1971) наблюдал около- 400 больных после резекции желудка по поводу рака, располагавшегося в пределах слизистой оболочки. Пять и более лет жили почти все, а у умерших за период наблюдения при вскрытии не обнаружено признаков опухоли. Эти классические наблюдения были подтверждены F. Dobroshve (1976).
Решение проблемы ранней диагностики рака желудка возможно путем организации активного выявления больных среди населения путем формирования групп повышенного риска и проведения тщательной диспансеризации. Задача эта стала реальной благодаря внедрению в практику современной гастроскопической аппаратуры. Изучать проблему ранней диагностики и анализировать накопившийся опыт весьма трудно в значительной степени из-за того, что нет общепринятой терминологии. Существует несколько понятий, характеризующих начинающийся рост рака желудка: начальный рак, минимальный рак, ранний рак. малый рак, поверхностный рак и др. Существующие определения рака желудка по международной системе как T1N0M0 или по- отечественной классификации как I стадия оказываются недостаточными. В пределах I стадии рака желудка встречается разнообразие клинических и морфологических проявлений этого заболевания, которые требуют разного отношения в смысле выбора- метода лечения и определения прогноза.
Ранний рак желудка имеет три характеристики: клиническую. морфологическую, биологическую. Клиническая характеристика основывается на данных предоперационного обследования. Морфологические исследования позволяют уточнить клиническое определение. Биологический аспект отражает совокупность общих и местных изменений, взаимоотношения организма больного и злокачественной опухоли.
В 1908 г. М. Verse описал 12 наблюдений рака желудка в пределах слизистой оболочки. В дальнейшем анализ ранних стадий рака желудка провел М. Ribbert (1911). В 1936 г. J. Ewing, ■а в 1937 г. Bertrand и Konjetzny сформулировали понятие «поверхностный рак желудка» — опухоль в пределах слизистой оболочки. Предлагавшиеся впоследствии определения начальных •форм рака желудка оставляли до начала 60-х годов незыблемым основной критерий — отсутствие инвазии подслизистого слоя стенки органа.
В 1956 г. R. Hess впервые предложил понятие «ранний рак желудка». При этом автор имел в виду рак в пределах подслизистого слоя вне зависимости от инвазии лимфатических узлов. По предложению японских обществ эндоскопистов и гастроэнтерологов (1962) этот термин получил широкое распространение и в настоящее время является наиболее употребительным в литературе [Murakami Т. 1971; Johansen А. 1976; Morosn В. 1979]. После накопления клинического опыта возник вопрос о неоднородности заболеваний, объединяемых этим термином. R. Hess обозначал им группу рака, имеющего различные биологические характеристики (уровень инвазии стенки, поражение лимфатических узлов). Хотя ранний рак желудка считается потенциально излечимым заболеванием, в настоящее время стало очевидным, что увеличение площади поражения слизистой оболочки обычно сопровождается инвазией подлежащих слоев и увеличением вероятности метастатического поражения лимфатических узлов [Hayashida Т. Kidakoro Т. 1969, 1970; Fujita S. 1978].
По мере развития эндоскопии были введены в обиход термины «микрокарцинома» (опухоль диаметром до 3 мм), «минимальный» рак (до 5 мм), «малый рак» (до 1 см). В настоящее время терминологические споры, по крайней мере в отечественной литературе, ведутся по поводу определения допустимого для «раннего рака желудка» уровня инвазии стенки, площади поражения и метастатического компонента.
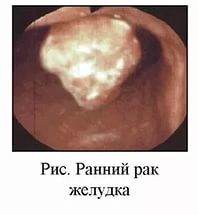
РАННИЙ РАК ЖЕЛУДКА
Н. Н. Малиновский и соавт. (1980, 1983) подчеркивают, что ранним раком можно считать лишь опухоли в пределах слизистой оболочки без метастазов. Н. Н. Соколов и Н. А. Усов (1976) понятие «малый рак» ограничивают поражением слизистой оболочки 2—3 см в диаметре. Термином «ранний рак» А. А. Кли- менков и соавт. (1980) обозначают опухоли в пределах слизистой оболочки диаметром до 3 см без метастазов.
В целом в литературе преобладает тенденция к ограничению площади поражения. Известно, что при опухоли желудка диаметром до 5 мм в 15,5% наблюдений отмечается инвазия подслизистого слоя [Oohara Т. et al. 1982]. Вместе с тем Н. Tsukuma и соавт. (1983) рак в пределах слизистой и. подслизистой оболочек считают ранним независимо от размера опухоли.
Собственный опыт позволил нам в свою очередь сделать по
пытку определения начальных этапов развития опухоли с клинических и морфологических позиций. Рентгенологическое или эндоскопическое выявление опухоли диаметром до 1 см позволяет диагностировать малый рак желудка. Понятие это чисто клиническое, определяющее лечебную тактику. По нашему мнению, «ранний рак» понятие клинико-морфологическое. Оно обозначает •опухоль в пределах слизистой оболочки без метастазов. Клинический диагноз «малый рак желудка» уточняется после морфологического исследования операционного препарата [Петерсон Б. Е. Грачева Л. С. 1981].
К ранней онкологической патологии желудка следует относить не только «фоновые» заболевания и предраковые изменения слизистой оболочки, но также прединвазивный рак TIS. Эти формы требуют от современного онколога знания особых диагностических приемов и специфического подхода к лечению.
Для глубокого понимания динамики процессов канцерогенеза в гастрологии необходимо иметь четкое представление об основных факторах, влияющих на малигнизацию.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
П литературе приводятся разные по степени аргументированности доказательства связи между характером питания и заболеваемостью раком желудка. Однако до сих пор не найдено характерного продукта питания для районов с высокой распространенностью заболевания, хотя и отмечается более частое употребление жареных блюд, растительных продуктов с твердой оболочкой (злаки, кукуруза, бобы и некоторые ягоды), маринованных и .квашеных овощей, вяленой рыбы [Correa Р. et al. 1976; Tulini- us H. 1978; Cummings J. H. 1978].
Установлено, что заболевшие в прошлом чаще нарушали режим питания, принимали пищу со значительными перерывами, часто переедали, чаще употребляли в больших количествах жирную и пережаренную пищу, крепкие спиртные напитки и реже молочные продукты [Райхман Я. Г. 1978].
Выраженная тенденция к увеличению заболеваемости раком желудка при питании свиным мясом и жиром обусловлена неблагоприятным влиянием этих продуктов на липидный и другие виды обмена [Бурмейстер М. Ф. Жихарев Л. В. 1966], на выработку и активность ряда пищевых ферментов [Скулме К. А. Ян- соне И. Л. 1966], на желудочную секрецию [Абельсон Ю. О. Закс М. Г. 1969].
Защитное действие сырых овощей и аскорбиновой кислоты объясняется подавлением образования нитрозаминов [Halnszel W. et al. 1976].
Для разных групп населения характерны определенные диетические привычки. Например, употребление специй для одних является обычным на протяжении многих поколений, а в пище
других они используются реже. Хотя среди любителей специй рак; желудка встречается реже, это не значит, что приправы обладают антиканцерогенным действием. Иначе говоря, закрепленные в процессе филогенеза привычки вырабатывают в организме приспособительные и адаптационные механизмы. При отсутствии, адаптации к такой пище, изменение диеты может вызвать воспалительные изменения слизистой оболочки желудка с переходом; в дальнейшем в хронический гастрит и другие предраковые заболевания [Грубарь В. Л. 1970].
Факт нивелирования через ряд поколений уровня заболеваемости раком желудка у эмигрантов и коренного населения позволяет предполагать, что пища играет лишь роль модифицирующего фактора онкогенеза, не определяющего абсолютно условия: появления опухоли.
Начинает выясняться и роль генетических факторов в патогенезе рака желудка. Свидетельство этого неравномерная заболеваемость в разных этнических группах и все чаще выявляемые’ случаи семейного рака желудка.
Для рака желудка характерна и почвенно-климатическая (гео- гидрохимическая) обусловленность [Райхман Я. Г. 1978]. Более высокая заболеваемость наблюдается в зонах с увеличенным содержанием в почвах органических веществ (гумус), относительно высокой кислотностью, с повышенным содержанием в поглощающем комплексе почв кальция, подвижных форм меди, цинка ш марганца, пониженным содержанием кобальта и низкой минерализацией питьевых вод (менее 1 г/л). В районах, где население употребляет воду повышенной минерализации (1,5—2 г/л и более), сульфатно-хлоридную, магниево-натриевую, заболеваемость раком желудка ниже. Из всего комплекса геогидрохимических элементов природной среды наибольшее влияние на заболеваемость раком желудка оказывают общая минерализация питьевой воды, растворенный в ней цинк и далее в убывающей степени ■— хлориды, сульфаты, кальций и магний, а также кобальт, медь и марганец почвы.
По мнению II. А. Боговского (1978), пищевые продукты не являются носителями канцерогенов, а лишь создают условия для проявления канцерогенного эффекта. Например, предполагается, что нитрозосоединения образуются из нитритов слюны и азотсодержащих компонентов пищи, воды. В этом процессе активно участвуют микроорганизмы, число которых особенно увеличивается при различных воспалительных процессах в полости рта и других отделах пищеварительного тракта.
Определенное значение в антиканцерогенном действии имеют крупномолекулярные соединения желудочного сока. Мукоеубстан- ции обладают выраженными защитными свойствами по отношению к механическим, термическим и химическим воздействиям, что обусловлено содержанием в слизи кислых сульфатированных мукополисахаридов и сиаловых муцинов, которые входят в состав желудочных му ко субстанций [Касьяненко И. В. 1974].
В норме слизистый барьер препятствует проникновению ниг- розосоединений в клетки желудочного эпителия [Tatematsu М. et al. 1976; Futoshi L. 1976], но при постоянном и длительном воздействии неблагоприятных факторов, он подтверждается, изменяется pH, создаются условия для превращения микробами нитратов в нитриты, канцерогенное воздействие которых трансформирует клетки слизистой оболочки в злокачественные. Н. Endo и соавт. (1977) для изучения возможного превращения пищевых компонентов в желудочные канцерогены использовали N-метил- .РУ-нитро-М-нитрозогуанидин, который может образовываться из К-метил-К-нитрогуанидина и нитритов в желудочном соке, а также естественные производные гуанидина. Мутагенностью обладает только метилгуанидин после нитрозирования в желудочном соке. Образующийся метилнитрозоцианамид как мутаген приблизительно в 10 раз более активен, чем нитрозогуанидин.
В ряде работ существенное значение в патогенезе рака желудка придается полициклическим ароматическим углеводородам, в частности бензпирену, а также нитрозоаминам [Stavron D. et al. 1976].
Экспериментально доказано, что к химическим веществам, индуцирующим железистый рак желудка, относятся ароматические амины (2,7-флюоренилбисацетамид) и N-оксипроизводные этих .веществ, а также продукты нарушения обмена триптофана и некоторых гормонов.
Некоторые указывают на связь между приемом алкоголя и раком желудка. У алкоголиков возникает предрасположение к развитию опухоли вследствие изменения реактивности к токсическим влияниям, расстройств питания, развития цирротических изменений печени [Kissin В. et al. 1974]. Оказывают влияние также канцерогенные добавки к некоторым алкогольным напиткам (афлатоксин в японской рисовой водке, нитрозоамины в замбийской «Kahasu»). Алкоголь является кокаццерогеном. Кроме того, он угнетает слюноотделение; нарушается механизм промывания и разведения, вследствие чего в слюне повышается концентрация токсических веществ (табак) в слюне.
Р. Correa и соавт. (1976) считают, что начало канцерогенеза следует искать в первые годы жизни человека. Риск заболевания раком желудка зависит от условий в первые 10 лет жизни. Эти авторы различают две формы рака желудка — диффузную (эндемическую) и кишечную (эпидемическую). Возрастная кривая заболеваемости при первой форме менее крутая, чем при второй. В пожилом возрасте заболеваемость одинаково быстро нарастает в странах с высоким и низким риском рака яселудка. Авторы связывают это с длительностью «инкубационного периода» опухоли и естественным развитием предраковых изменений слизистой оболочки.
Не менее важную роль в онкогенезе играют местные условия. К ним следует отнести все те состояния желудка, которые способствуют пролонгированному контакту канцерогенов со слизи-
стой оболочкой желудка. Огромный опыт клинической медицины! свидетельствует о связи желудочной секреции, нарушения эва- куаторной функции желудка с хроническими гастритами и раком. В работах Ю. М. Лазовского, проводившего глубокий анализ функциональных и морфологических изменений, доказано значение порой малозаметных физиологических нарушений в развитии предрака и рака желудка.
Г. Н. Архиповым на классических моделях И. П. Павлова при специальном кормлении с индукцией невроза у крыс созданы состояния гинерсекреции и ахилии. При алиментарной и невротической гипосекреции опухоли возникали в 30—46% случаев. У крыс с гиперсекрецией ни в одной серии опытов опухолевых поражений не установлено. Было лишь неясно, каким образом ахилическое состояние благоприятствует канцерогенезу.
В последнее время накапливается все больше данных о роли нарушенного обмена веществ в патогенезе рака желудочно-кишечного тракта. Речь идет не только о нарушении белкового, жирового и углеводного обмена, но и об изменении ферментно-гормонального механизма его регуляции [Holmes G. К. et al. 1976].
Об общности этиологии и патогенеза злокачественных опухолей свидетельствуют и случаи первично множественного рака желудка и других органов [Kumoto F. et al. 1976; Hoshi S. 1976; Muto G. et al. 1976, и др.].
Таким образом, в последние годы многие вопросы патогенеза рака желудка получили дальнейшую разработку, но пока они далеки от окончательного решения.
Рак желудка обычно развивается в патологически измененных тканях. Трудно предположить, чтобы он появлялся на совершенно здоровом фоне. Правда, в некоторых клинических наблюдениях нет указаний на предшествующие заболевания, но это не
означает, что их действительно не было или нет. Ретроспективный взгляд на развитие учения о предопухолевых заболеваниях подтверждает это мнение. В настоящее время стали выявлять изменения на уровне внутриклеточных структур, молекулярных и генетических элементов.
Предопухолевая патология желудка в связи с высокой частотой рака данной локализации имеет большое значение для практики здравоохранения. Не случайно проводится диспансеризация ■больных хроническими гастритами, язвой и полипами желудка. Изменения в слизистой оболочке, наблюдающиеся после резекции желудка и при пернициозной анемии, также предрасполагают к развитию рака. Несомненно, приведенный перечень заболеваний не является исчерпывающим и со временем, очевидно, эта патология будет более точно разграничиваться.
В литературе продолжает остро дискутироваться вопрос о том, что следует называть гастритом. Естественно, что с развитием и внедрением в широкую практику гастробиопсии появится больше возможностей для конкретизации этого понятия, выделения различных форм ранней онкологической патологии. Расшифровка «фоновых» заболеваний позволит отвергнуть утверждение некоторых авторов, что гастрит не имеет отношения к раку, и одновременно. предостеречь других от абсолютизирования гастрита как предрака.
Ц. Г. Масевич (1969) различал следующие виды гастритов: 1) поверхностный; 2) с поражением желез без атрофии; 3) атрофический; 4) атрофически-гиперпластический. Автор приходит к выводу, что наиболее благоприятным фоном для развития рака желудка служит атрофический гастрит с явлениями перестройки эпителия слизистой оболочки (дисрегенераторный) и атрофически- гиперпластический (с дисрегенераторной гиперплазией) гастрит. Именно эти формы гастрита сопровождаются выраженным снижением секреторной функции желудка. Представляют интерес наблюдения М. Siurala и соавт. (1974) за больными атрофическим гастритом, проводившиеся в течение 19—23 лет. Установлена высокая степень наследуемости атрофического гастрита (в 79,5+25,2% случаев), а также существование общих генетических факторов предрасположенности к раку желудка и гастриту.
М. Zkekki и соавт. (1975) также обследовали большую группу родственников больных раком желудка. Лица из семей больных слизистым раком более предрасположены к гастриту, чем другие обследованные родственники.
По данным J. М. Maillard и соавт. (1975), наибольшую угрозу злокачественной трансформации представляют хронические атрофические гастриты с гипоацидозом, ахлоргидрией, кишечная метаплазия слизистой оболочки, полипы и полипоз, гипертрофический гастрит Менетрие.
Н. Н. Еланский (1962) гастрит в анамнезе больных раком желудка отметил в 85% случаев. Аналогичные данные приводят
Н. Н. Александров, А. Б. Синицын (1979). Трансформацию атрофического и гипертрофического гастрита непосредственно в рак наблюдал О. Грегор (1968).
Большой интерес представляют исследования, проведенные в Киевском НИИ экспериментальной и клинической онкологии Министерства здравоохранения УССР и в Институте проблем онкологии АН УССР. Отчетливо показана динамика морфологических* гистохимических и биохимических изменений по мере прогрессирования гастрита, перехода поверхностных в атрофические формы. В ранних стадиях более определенно отмечается накопление нейтральных мукополисахаридов в цитоплазме главных клеток. В дальнейшем наряду с морфологическим изменением самих клеток поверхностного эпителия еще больше нарушается их биохимическое равновесие, наблюдается накопление нейтральных и кислых мукополисахаридов в не свойственных им участках.
При длительном течении гастрита наступают выраженная инфильтрация слизистой оболочки и интенсивная сосудистая реакция, уменьшается число фундальных желез, развивается атрофия. Гистохимически это выражается в обеднении слизистой оболочки пластическими белками, нейтральными и кислыми мукополисаха- ридами, ДНК и РНК, что свидетельствует о нарушении метаболизма и развивающейся дистрофии. Значительно сужается зона секреции мукоида в поверхностном и ямочном эпителии, секрет становится более плотным и выброс его из клетки затрудняется. Перегрузка эпителия мукоидом приводит к массовой гибели клеток поверхностного эпителия, отторжению их и образованию микроэрозий [Касьяненко И. В. и др. 1974]. На следующем этапе происходит перестройка эпителия по кишечному типу.
В последние десятилетия наблюдается неоправданная тенденция к скептицизму в отношении кортико-висцеральных влияний на развитие предопухолевых поражений желудка. Во время секреторного процесса в железистых клетках выявляются структурно-морфологические изменения, обратимые в физиологических условиях, но приводящие к перестройке и гибели клеток при длительном возбуждении [Скулме К. А. 1959, и др.]. При функциональных. расстройствах секреция раньше и значительнее нарушается в сложно-рефлекторную, при морфологических изменениях железистого аппарата в нервно-химическую фазу [Быков К. М. Курцин И. Т. 1952, и др.]. Сохранение второй фазы секреции при отсутствии первой — признак частичного повреждения фундальных желез, выделяющих слизь, предохраняющую желудок от вредных воздействий [Лазовский Ю, М. 1947, и др.]. Причиной гастрита является длительное функциональное перенапряжение желудка, не связанное с воспалением. Стойкие патологические импульсы ведут к нарушению координации между фазами желудочной секреции, что приводит к дисрегенераторной гиперплазии слизистой оболочки с аденоматозными и папиллома- тозными разрастаниями или арегенераторной атрофии.
Большое значение в патогенезе рака желудка придается мета- аплазии эпителия по кишечному типу. Известно, что она усиливается с возрастом, встречается при полипозе и атрофическом гастрите [Takashi S. 1974; Tomoyuki К. 1975; Laslo S. et al. 1975; Correa P. et al. 1976].
Этиология полипов остается невыясненной. Ряд авторов относят их к порокам эмбрионального развития. Некоторые указывают на этиологическое значение хронического воспалительного процесса с избыточной регенерацией слизистой оболочки. Подтверждением последней гипотезы является довольно частое выявление при полипах различных форм гастритов, в большинстве, •случаев ахилического. Появление аденоматозных полипов может •быть обусловлено действием некоторых химических веществ, добавляемых к пище. Экспериментально установлено, что исключение афлатоксина из рациона форели привело к снижению частоты полипоза желудка со 100 до 0—3%. Возможно, что онкогенез у человека частично осуществляется по сходной схеме, но вещество, обладающее избирательной способностью прямо или косвенно приводить к развитию полипов, неизвестно [Kimura Z. •et al. 1976].
По данным литературы, частота превращения полипов в рак жолеблется от 2,8 до 60%. Хотя единого мнения о характере полипов, склонных к малйгнизации нет, большинство исследователей указывают, что множественные, крупные, на широком основании образования, локализующиеся в проксимальном отделе желудка, чаще трансформируются в рак. Н. А. Краевский (1934) разделяет полипы на безусловно доброкачественные, относительно доброкачественные и безусловно злокачественные. Такое разделение нередко весьма затруднительно. Нельзя не согласиться ■с В. X. Василенко и соавт. (1977), что «определить грань между аденоматозом и воспалительно-гиперпластическими полипами желудка даже с применением специальных гистологических методов исследования не всегда возможно».
И. Б. Розанов и В. А. Маневич (1961) считают целесообразным деление полипов на доброкачественные, переходные (или подозрительные в отношении малигнизации) и малигнизированные. В доброкачественных полипах, как бы ни были выражены железистая гиперплазия и гипертрофия, железы никогда не выходят за пределы мышечного слоя слизистой оболочки. При переходных формах отмечаются анаплазия, диекомплексация и пролиферация клеток эпителия, образование атипичных желез. Для малигнизированных полипов характерны нарушение собственной оболочки желез и внедрение клеток через мышечную оболочку слизистой оболочки в подслизистый, слой.
Подобные закономерности характерны и для язвы желудка. являющейся одним из частых предраковых состояний. В малигнизации язвы гастрит также играет существенную роль [Масе- вич Ц. Г. 1969, и др.].
Частота малигнизации, по данным литературы, также колеблется в широких пределах, поскольку часто невозможно установить, какой процесс является первичным — рак или язва. Первично изъязвленный рак иногда ошибочно принимают за малигнизированную язву [Kawai К. 1974; Gloor F. 1975].
Значительный интерес представляют наблюдения G. Марре» (1974), показавшего, что через 15 лет после резекции желудка по поводу язвы угроза развития рака желудка повышается в= 8 раз по сравнению с общей популяцией.
Эти выводы подтверждаются исследованиями, проведенными-
J. Fanunger и соавт. (1975). Во многих случаях в культе желудка у 215 больных, оперированных 10—20 лет назад по поводу доброкачественной язвы желудка, обнаружены одиночные и множественные полипы, а микроскопически — признаки острого и* хронического воспаления различной степени, метаплазия эпителия по кишечному типу и кистозная дегенерация желез. Эти изменения одинаково часто наблюдаются после резекции по Бильрот I и Бильрот II. Повышение риска развития рака желудка в. условиях послеоперационного атрофического гастрита и метаплазии слизистой оболочки по кишечному типу отметили В. Puli- mood и соавт. (1976), Т. Terjesen и Н. G. Frihsen (1976), L. Do- meloff и соавт. (1976), Е. Kiuilakso и соавт. (1977), F. OrcallL и соавт. (1978).
К ранней онкологической патологии желудка мы относим предраковые изменения слизистой оболочки, carcinoma in situ и инвазивный рак (опухоль диаметром до 1 см), не прорастающие в- подслизистый слой. В морфологическом аспекте предраком считаем не все разновидности гастрита, язв, полипов желудка, а лишь, те из них, при которых наблюдается очаговая пролиферация эпителия атипического характера или дисплазия I—III степени.
При дисплазии I степени (рис. 87, 88) железистые трубки состоят из высокого цилиндрического эпителия с удлиненным. темно окрашенным ядром. Ядерно-цитоплазматическое отношение слегка выше, чем в нормальном или метаплазированном (кишечный тип) эпителии. Величина и форма ядер одинакова (одыо- морфность), их апикальный конец заострен, набухание ядрышек: не заметно. Ядра расположены тесно (тип А), кое-где в два ряда, находятся в нижней части клетки. Надъядерная часть цитоплазмы содержит секреторные гранулы, дающие интенсивную ШИК-положительную реакцию. Митозы редки,- При типе Б наблюдаются небольшое укрупнение и округление ядер при сохранении однорядности.
II степень дисплазии характеризуется железами с двух-, и трехрядным расположением ядер и уменьшением секреции (тип А). Отдельные ядра в некоторых железах достигают поверхности клетки. Встречаются митозы. При типе Б появляются незначительный полиморфизм укрупненных ядер, клетки приобретают кубическую форму (рис. 89, 90).
При дисплазии III степени большая часть желез имеет многорядную выстилку со сниженной секрецией, что особенно хорошо выявляется при использовании ШИК-реакции. Встречаются железы, в которых отдельные ядра имеют закругленный .апикальный конец и овальную форму, четко обозначаются ядрышки. Митозы часты. При типе Б наблюдается значительный полиморфизм однорядно расположенных клеток (рис. 91, 92).
На основании только гастробиопсии (обычно поверхностно •взятого кусочка слизистой) не всегда удается определить форму гастрита, характер язвы и полипа. При исследовании биоптатов на первый план выступает необходимость определения состояния эпителия слизистой оболочки желудка в отношении его пролиферативной активности и степени катаплазии клеток, т. е. решения вопроса о наличии или отсутствии в исследованном материале морфологически определяемого предрака. При цитологическом исследовании отчетливо прослеживается выраженная тенденция к увеличению клеток по мере нарастания степени дисплазии. При .дисплазии III степени значительное число клеток имеет площадь 700—1200 мкм2. Цитометрическая кривая сдвинута вправо. Укрупнение клеток сочетается с увеличением ядерно-цитоплазма- тического отношения, величины которого при дисплазии и умеренной пролиферации статистически различны.
При дисплазии I и II степени отмечается увеличение окра- шиваемости ядра и цитоплазмы, размеров ядра (рис. 93, 94, 95). В единичных клетках выявляются укрупненные ядрышки, нечеткость клеточных границ и стекловидная цитоплазма.
При дисплазии III степени клетки становятся несколько атипичными, что их нередко не удается отличить от клеток рака (рис. 96).
Цитологическая гипердиагностика рака при дисплазии относительно редка, так как нет присущего раку клеточного полиморфизма: клетки с признаками атипичности сходны по размерам, форме, степени окрашиваемости.
Описанные выше клеточные изменения характеризуют дисплазии различной степени выраженности независимо от того, на фойе какого патологического процесса они выявлены.
При сочетании дисплазии с кишечной метаплазией в метапла-
аированных клетках изменяется главным образом морфология ядер: увеличиваются их гиперхромия, неровность контуров в неравномерность распределения хроматина (рис. 97). Метапла- зированные (бокаловидные) клетки (рис. 98, 99) отличаются от клеток желудочного эпителия также высоким содержанием кислых мукополисахаридов (рис. 100). При этом интенсивность цитохимической реакции по мере нарастания пролиферативных изменений не снижается.
Значительные трудности представляет дифференцирование пролиферирующих метаплазированных клеток перстневидно-клеточного рака. Для последнего характерно присутствие в ядре резко увеличенных ядрышек, глыбчатого хроматина и множественных крупных, светлых, прозрачных вакуолей.
При дисплазии в цитологически выявляемых многоклеточных комплексах, обрывках тканей удается отметить нарушение структуры эпителиального пласта, многорядность, дискомплекцию с беспорядочным нагромождением клеток, заполнение просвета желез (рис. 101, 102, 103).
Возможности цитологического исследования при установлении: характера предракового процесса ограничены [Клюкина Л. Б. 1973; Лукина Т. А. 1970, 1976; Пинская М. Н. 1974, 1976; Жу- чина Т. С. 1978]. Задача цитолога при исследовании материала, полученного во время гастроскопии, сводится к оценке выраженности пролиферативных изменений в эпителиальных клетках с основной целью — не пропустить клеток рака. Как показывают материалы МНИОИ, правильное определение степени пролиферативных изменений в эпителии при изучении мазков-отпечатков с кусочков слизистой оболочки желудка при гастритах, полипе и язве желудка оказалось возможным в 76,2—83,6 % случаев [Ага- мова К. А. и др. 1978].
Закономерность цитологических изменений позволяет не только указать на пролиферацию (умеренную, резко выраженную с. атииией клеток, а также подозрительную на переход в рак), но и определить характер пролиферирующего эпителия (покровноямочный, железистый, метаплазированный). Имеется также возможность установить своеобразие многоклеточных структур, присущих полипу (массивные сосочкоподобные структуры из плотнорасположенных клеток покровно-ямочного, иногда железистого эпителия, часто с наличием метаплазированных клеток), пролиферацию клеток регенераторной зоны при атрофически-гиперпла- стическом гастрите, своеобразную плазмоклеточно-эозинофильно- нейтрофильную ассоциацию, обычно сопутствующую хронической язве [Жучина Т. С. 1978].
При анализе результатов гастробио’псий, проведенных в 1979 г. у 223 больных хроническим гастритом, язвой желудка, полипом. дисплазия выявлена в 33,7% наблюдений, т. е. у каждого третьего обследованного больного почти с равной частотой на фоне всех трех заболеваний (табл. 22). Наиболее редко отмечена дисплазия III степени (5% больных).
Carcinoma in situ. желудка признается в настоящее время ■большинством авторов [Пайкова Л. В. 1972; Серов С. Ф. Смирнов Н. М. 1974; Аруин Л. И. и др. 1974; Головин Д. И. 1975; Гольберт 3. В. 1978]. Однако многие вопросы биологической сущности и морфологической диагностики этого состояния не решены. Рассматривая разные аспекты проблемы прединвазивного рака желудка, В. Kraus и Н. Cain (1979) отмечают, что эта локализация требует особого подхода. В желудке отношение площади эпителия к площади стромы значительно выше, чем, например, в шейке матки, а подлежащие структуры более рыхлые, поэтому период между замещением поверхностного или железистого эпителия атипичными клетками и началом инвазии значительно короче.
Термином «прединвазивный рак» обозначают изменения, при •которых анаплазированные клетки выстилают слизистую оболочку а. (или) железы желудка, без выхода за пределы базальной мембраны (рис. 104, 105). Клетки эпителия полиморфные, частью цилиндрические, частью округлой или полигональной формы, расположены как в один, так и в несколько рядов. Ядра имеют разную величину, окраску и формы, часто светлее обычных, с выраженным ядрышком. Многие клетки утрачивают секреторную активность и полярность расположения. Заметно увеличено ядер- но-цитоплазматическое отношение. Много митозов. Диагностика этой стадии рака желудка несомненно значительно труднее, чем при поражении многослойного плоского эпителия, в котором очаг малигнизации четко отграничивается от подлежащей основы.
На фоне атрофически-гиперпластических процессов, полипов, когда железы утрачивают правильное расположение, извиваются, кистозно расширяются и на срезах располагаются беспорядочно, при carcinoma in situ очень трудно исключить инвазивный рост (микрокарцинома). Без особого труда диагноз «прединвазивный рак» ставится при сохранении правильного взаимоотношения и хода пораженных желез (см. рис. 95). При цитологическом исследовании установить принципиальные различия клеточных характеристик carcinoma in situ и инвазивного рака не удаетс-я.
Малый рак желудка (опухоль диаметром 1 ем) описан лишь как редкая находка [Аруин Л. И. и др. 1974; Несветов Н. М. и др. 1974; Серов С. Ф. Смирнов Н. М. 1974].
В МНИОИ за 30 лет (с 1945 по 1974 г.) рак желудка до
1 см в диаметре обнаружен всего у 35 больных, главным образом на фоне хронической язвы (16 наблюдений) и в полипах (17 наблюдений). На фоне гастрита такой рак встретился лишь у
2 больных: у одного в сочетании с полипозной гиперплазией слизистой, у другого — при наличии полипа желудка, не связанног© с раком (табл. 23).
Такое соотношение предшествующих заболеваний при раке желудка на нашем материале мы считаем случайным. Оно обусловлено преобладанием хирургических вмешательств при полипах и хронических язвах. В связи с широким применением фибро- гастроскопии при гастрите выявлено уже 11 больных малым раком желудка (табл. 24), причем у 3 из них обнаружены микрокарциномы (рис. 106, 107)
Как видно из табл. 24, в большинстве случаев (в 9 из 11), рак желудка (опухоль диаметром менее 1 см) не прорастал в подслизистый слой. При гистологическом исследовании удаленных пнепаратов обнаружено, что у 2 больных малый рак не был ранним и у одного больного сопровождался метастазированием в регионарные лимфатические узлы.
Изучение гистологической структуры малого рака желудка показало, что на фоне полипов чаще всего возникают высоко- и умеренно дифференцированные аденокарциномы (рис. 108, 109, 110). Низкодифференцированный и слизистый рак не встречался, несмотря на частую энтерализацию эпителия.
В краях хронических язв выявлялись низкодифференцированная аденокарцинома и недифференцированный рак (рис. 111, 112, 113). В отдельных наблюдениях эти формы сочетались с перстневидно-клеточным и слизистым раком.
На фоне гастрита отмечались разнообразные гистологические формы малого рака с участками различной степени дифференци- ровки. При этом в поверхностных отделах слизистой оболочки обнаруживалась умеренно или высокодифференцированная аденокарцинома, а в более глубоких (на уровне желез) — недифференцированный рак из перстневидных клеток (рис. 114—117).
В 41 из 46 наблюдений опухоль инфильтрировала слизистый и подслизистый слои или только слизистую оболочку, т. е. имел место ранний рак. У 5 больных был частично поражен и мышечный слой (у 4 в краях язвы и у одного — на фоне гастрита). Метастазы рака в лимфатических узлах большого сальника обнаружены лишь в одном из 46 случаев: опухоль размером 0,3X0,3 см развилась в крае хронической язвы, инфильтрировала слизистый и частично подслизистый слой, имела гистологическое строение умеренно дифференцированной аденокарциномы с участками перстневидно-клеточного рака. Небольшие субкапсулярные метастазы в лимфатических узлах по своему строению были сходны с перстневидно-клеточным раком (рис. 118—120). Таким образом, в 5 наблюдениях опухоль не оказалась ранним раком.
У 28 больных мы имели возможность изучить окружающую опухоль слизистую оболочку. Рак у всех возник на фоне дисплазии II и III степени. Энтерализация эпителия отмечена в 20 наблюдениях.
Инвазивному раку присуще значительное многообразие цитограмм, отрангаюгцих особенности гистологического строения опухоли и степень» катаплазии (рис. 121—124; см. также рис. 37).
Идентификация клеток, обнаруженных в цитологических препаратах с клетками эпителия в гистологических срезах, показала, что клетки опухоли почти всегда присутствуют на фоне пролиферирующего покровно-ямочного и железистого эпителия. Интенсивность пролиферации обычно соответствует II и III степени дисплазии. Клетки обладают четко выраженной злокачественностью и по морфологическим признакам могут быть отнесены либо к аденокарциноме, либо к низкодифференцированному раку.
Дважды было дано заключение о перстневидно-клеточном раке. Таким образом, гастроцитограммы демонстрируют возможность определения степени дифференцировки опухоли.
Клиническая диагностика раннего рака желудка представляет значительные трудности. Опухоль может протекать под маской предшествующих заболеваний — язвенной болезни, полипоза, хронического гастрита. Перед клиницистом стоит важная в практическом отношении задача по выявлению малейших изменений в «привычном» течении хронического заболевания. Именно поэтому важную роль в своевременной диагностике рака желудка играет врач, осуществляющий диспансерное наблюдение. Большая ответственность лежит также на участковом враче, к которому обращаются как впервые заболевшие, так и больные с хроническими заболеваниями желудка.
Рак с коротким анамнезом, а тем более бессимптомный рак отмечается тем реже, чем тщательнее собран анамнез [Петров Н. Н. 1952, и др.].
Э. И. Ибрагимов и Ф. Г. Бахшалиева (1976) установили, что 65% больных обращаются за медицинской помощью в первые 3 мес после появления жалоб. Основная причина запущенности рака желудочно-кишечного тракта — недостаточное знание онкологии врачами общей лечебной сети и организационные недостатки в работе лечебных учреждений. Анализ диагностических ошибок и причин позднего выявления заболевания свидетельствует о растущей из года в год недооценке врачами анамнестических данных и стремлении проводить множество не всегда оправданных инструментальных исследований. Однако следует твердо помнить, что и в переживаемое нами время бурного технического перевооружения медицины тщательно собранный анамнез служит надежным путеводителем для правильного выбора диагностических методов исследования.
Выделяемый А. И. Савицким синдром малых признаков имеет несомненное диагностическое значение. Он обусловлен не столько анатомическими изменениями в желудке, сколько рано развива- g ющимися сдвигами в обменных, главным образом окислительновосстановительных процессах, т. е. нарушениями функции целых систем организма.
А. И. Савицкий включает в синдром малых признаков дискомфорт (чувство полноты и тяжести) в подложечной области, потерю удовлетворения от еды, неприятный вкус, рвоту, отрыжку, тошноту, плохое общее самочувствие, усталость, снижение трудоспособности, похудание, анемизацию, потерю интереса к окружающему, незначительные нарушения сердечно-сосудистой деятельности.
Для предопухолевых заболеваний желудка характерно постепенное развитие заболевания. Периоды обострения чередуются с более или менее длительными светлыми промежутками. Возникновение обострений обычно связано с нарушением режима питания, погрешностями в диете. При возникновении рака на фоне «полного здоровья», как правило, отмечается постепенное, неуклонное, иногда с короткими ремиссиями нарастание симптоматики. При развитии опухоли на фоне предшествующего заболевания, больные чаще предъявляют жалобы на усиление и большее постоянство ранее наблюдавшихся симптомов.
Нарушение аппетита’ — одно из частых проявлений раннего рака желудка — встречается в основном у людей среднего и старшего возраста. Как отмечает И. Д. Стражеско (1956), «эти боль- |(ные», отличающиеся хорошим аппетитом, начинают жаловаться <на его понижение, что нередко связано с чувством легкой тошноты; они еще охотно едят острую, пикантную пииту, но здоровая, ■простая пища, особенно мясная, употребляется ими неохотно, ■или даже с «отвращением».
К относительно ранним признакам рака желудка можно отнести также чувство давления, тяжести, распирания под ложечкой при быстром насыщении. Боль в животе — частый симптом. Однако вряд ли можно считать его признаком раннего рака желудка. Скорее всего это чувство дискомфорта в сочетании с другими неприятными ощущениями типа «сжимания», «давления», «переполнения». Настоящий, постоянный болевой синдром — это обычно последний, «пятый акт драмы, первые четыре которой проходят незамеченными» [Березов Ю. Е. 1976]. В то же время при появлении рака на фоне предракового заболевания болевой ■‘Синдром присутствует почти всегда. Характер боли при различных заболеваниях желудка неоднороден. При раке преобладает тупая ■£боль (сосущая, давящая, тянущая), при полипозе и анацидном гастрите — ощущение полноты, при других формах гастрита и язвенной болезни — боль острого характера.
Важна в диагностическом отношении связь боли с приемом сгшци. При раке желудка боль в основном мало зависит от приема пищи, но иногда усиливается после еды. При полипозе и «анацидном гастрите определенных закономерностей, как прави-
ло, не наблюдается. При язвенной болезни обычно у одних больных преобладает боль натощак, а у других через 1/2—2 чз после еды. Большинство клиницистов отмечают, ^что для язвенной болезни довольно характерна связь боли с едой.
При полипозе характер жалоб обычно зависит от сопутствующего гипацидного или анацидного гастрита. Кровотечения связывают с обилием кровеносных сосудов в полипах. При малигни- зации могут присоединяться боль, слабость, плохой аппетит, умеренно выраженная анемия.
На очередность появления клинических симптомов существенно! влияет локализация патологического процесса в желудке. Например, выраженная саливация характерна для рака кардиального* отдела. Рвоту, отрыжку тухлым вызывает опухоль дистального* отдела из-за раннего нарушения эвакуации. При поражении дна- желудка, так называемой немой зоны, первым клиническим признаком может быть необъяснимая анемия при общем хорошем самочувствии или боль в левой половине грудной клетки, иногда* симулирующая стенокардию. Таким образом, рак даже одной ® той же трети желудка может иметь различные начальные симптомы.
В заключение следует еще раз подчеркнуть, что клиническая! диагностика раннего рака желудка является чрезвычайно сложной. Патогномоничных симптомов нет. Талант клинициста-диа— гноста проявляется в том, чтобы основывать свои заключения на? комплексе анамнестических и клинических данных в динамике*, а не на отдельных симптомах.
Рентгенологическое исследование. При раннем раке и предшествующих заболеваниях желудка возможности рентгенодиагностики ограничены [Тагер И. Л. 1959; Меликова Ю. М. 1969;. Соколов Ю. И. и др. 1975; Власов П. В. 1974; Березов Ю. Е. 1976; Василенко В. X. и др. 1977; Frik W. 1974; Stegner Н, et al. 1975; Iieinkel К. et al. 1976]. R. Lambert и соавт. (1973) вообще не считают правомочным требовать от рентгенологов проведения дифференциальной диагностики хронической язвы, малигнизированной язвы и первично-язвенной формы рака. По их мнению, если «рентгенолог обнаружил такую картину в желудке. то на этом он выполнил свой долг».
Вместе с тем нельзя совершенно безнадежно оценивать перспективу рентгенодиагностики малого рака желудка. В определенном проценте наблюдений можно если не с уверенностью выявить, то заподозрить малигнизацию. Н. Shirakabe и соавт. (1972) рентгенологически малый рак желудка обнаружили у 32% больных, а при гастроскопии без биопсии — у 59 %.
Необходимо скрупулезно соблюдать современные методики» рентгенологического исследования. Они должны включать исследование в различных положениях больного, применение заэкранною пальпации, тщательное.изучение рельефа слизистой оболочки, использование двойного, а при показаниях тройного контрастирования, париетографии и других вспомогательных приемов-и обору-
давания (в том числе использование рентгенотелевизионной аппаратуры и электронно-оптических преобразователей).
Уместно обратить внимание на тот факт, что эффективность рентгенологической и эндоскопической диагностики во многом ■•определяется знанием специалистами многообразия вариантов .ранней онкологической патологии, механизмов их развития, ■их макро- и микроструктуры. Можно приветствовать стремление рентгенологов к участию в эндоскопическом исследовании и изучении удаленного препарата желудка. И. Л. Тагер (1959) объяснял ошибки рентгенологов не невидением, а неведением.
При раковой инфильтрации слизистой оболочки нормальный .рельеф ее нарушается и появляется феномен ступеньки [Василенко В. X. и др. 1977] или феномен многоконтурности [Власов П. В. 1974]. В этой зоне перистальтика, как правило, не прослеживается.
Если инфильтрация располагается в кардиальном отделе, то .могут наблюдаться зияние кардии из-за ригидности стенок, желудочно-пищеводный рефлюкс, уменьшение (исчезновение) газового пузыря или же, напротив, задержка контрастного вещества выше места сужения и переполнение воздухом газового пузыря
• вследствие стеноза. Подобные состояния надо дифференцировать «от недостаточности кардии, обусловленной скользящей грыжей пищеводного отверстия диафрагмы, или изолированной, а также кардиоспазма.
Диагностика раннего инфильтративного рака области свода желудка представляет наибольшие трудности даже для опытного (рентгенолога и эндоскописта. Клинические симптомы присоединяются поздно, когда опухоль достигает больших размеров, поэтому для ее своевременного выявления могут понадобиться вспомогательные приемы.
В области тела желудка участки инфильтрации проявляются аперистальтическими зонами, нарушением рельефа слизистой оболочки, выпрямлением малой кривизны, симптомом ступеньки [Василенко В. X. и др. 1977], Инфильтрация препилорического «отдела характеризуется симптомом удлинения привратника, стенозом или же его зиянием с ускоренной эвакуацией из желудка.
При изъязвлении в зоне инфильтрации (первично-изъязвленный рак). помимо перечисленных симптомов, наблюдается симптом ниши. Последняя обычно не образует по окружности инфильтративный вал правильной округлой формы, имеет неодинаковую •толщину, а складки слизистой оболочки нередко обрываются у самого края ниши. Феномен конвергенции утолщенных складок слизцстой оболочки к нише или дефекту наполнения при раке может быть объяснен инфильтрацией подслизистого слоя по периферии опухоли, т. е. прогрессированием инвазивного процесса [Тагер И. Л. 1959].
Первично-продуктивные формы начального рака представля- вот меньшие трудности для рентгенодиагностики. Дифференциация от полипа обычно проводится только с помощью биопсии. На
современном этапе рентгенологические методы исследования неи позволяют точно дифференцировать доброкачественные полипы? от малигнизированных.
Начальные стадии рака желудка имеют много общих рентгенологических симптомов с различными формами гастрита, особен’ но очагово-гипертрофическими, ригидными. Даже гастроскопия с; биопсией иногда не позволяют окончательно разрешить сомнения.
Описанные выше рентгенологические признаки раннего ракая желудка имеют относительное значение. В отличие от гастрита » ранних стадиях опухоли наиболее часто выявляется такой функциональный признак, как отсутствие перистальтики. Локальное- или тотальное утолщение складок, нарушение их расположения? более характерны для гастрита.
Таким образом, рентгенодиагностика раннего рака желудка еще не может претендовать на ведущую роль. Результаты ее должны учитываться в комплексе с данными, полученными другими1 клинико-диагностическими методами. Тем не менее на ранний!’ рак подозрительны: 1) минимальные, ограниченные по площади? участки перестройки рельефа слизистой оболочки с утолщением^ хаотичным расположением складок, стойким утолщением даже- одной из них; 2) наличие повторяющегося на рентгенограммах, депо бария среди утолщенных или деформированных складок. даже если оно еще не имеет типичной картины «ниши»; 3) выявление на небольшом участке сглаженности складок слизистой’ оболочки, неровности, шероховатости, зазубренности контура малой кривизны.
Гастроскопия. Эндоскопическая диагностика за последние два? десятилетия получила значительное развитие в связи с разработкой и применением усовершенствованных эндоскопов на стекловолоконной оптике. Тем не менее по-прежнему остается в силе» положение: чем меньше поражение, тем труднее оно обнаруживается и тем менее характерны его эндоскопические признаки. Весьма показательны данные Т. Kunio (1974), изучавшего предел: выявляемости малого рака желудка (опухоль диаметром до 1 см) при гастрофиброскопии у 67 больных и отметившего, что лишь, у 12 опухоль была распознана.
Современное эндоскопическое исследование при поиске рака’ желудка должно быть направлено на выявление участков сглаженности слизистой оболочки, полиповидных или подушкообразных выбуханий без привычной картины складчатости слизистой: оболочки, участков локальной гиперемии со стойкими фиброзными наложениями и контактной кровоточивостью, а также зок! втянутости рельефа ограниченного характера по сравнению с.- окружающими участками.
Основываясь на большом количестве наблюдений, японские- общества гастроэнтерологов и эндоскопистов в 1962 г. предложили следующую классификацию макроскопических форм раннего» (начального) рака желудка:
В. X. Василенко и соавт. (1977) считают наиболее рациональной классификацию, предложенную В. В. Серовым (1970) и дополненную Н. П. Вощановой и Л. К. Соколовым (1973): 1) полиповидный; 2) бляшковидный; 3) поверхностный; 4) изъязвленный.
Значение этих классификаций состоит в том, что они заставляют пересмотреть традиционное представление о раке желудка как образовании, имеющем привычные макроскопические черты, и направлять внимание эндоскопистов на поиски неоолыних, поверхностных изменений слизистой оболочки, значительно отличающихся от зрелых форм опухолей.
Как показывают данные литературы и собственный опыт, исключительно трудно не столько обнаружение при гастрофиброско- пии, сколько отождествление экспансивно растущих полиповидных образований независимо от их локализации. Нередко ни форма, ни поверхность образования, ни состояние пограничных отделов слизистой оболочки не являются основанием для дифференциальной диагностики.
В эндоскопической диагностике малигнизации полипов большее значение имеют размер образования (диаметр более 1,5— 2 см), ригидность и повышенная кровоточивость. Бугристые контуры при мягкой консистенции полипа, гиперемия, наличие эрозий и фиброзных наложений на поверхности нередко свойственны полипам желудка в стадии воспаления.
При возвышенном типе раннего рака желудка на ^нашем материале эндоскопические признаки злокачественности были выявлены лишь у 50% больных, а в 90% наблюдений решающая роль в диагностике принадлежала гастробиопсии.
Начальные поражения эндофитного характера можно различить прежде всего благодаря цветовому контрасту между белесоватой сглаженностью участка рельефа и более ярким (красным) окружающим фоном. При развитии рака на фоне атрофических изменений слизистой оболочки диагностическое значение приобретает оценка сосудистого рисунка, который нарушается в зоне — опухолевого роста.
Поверхностные злокачественные инфильтрации весьма сходны с легко ранимыми выбуханиями, наблюдаемыми при гастритах. Правда, в этом случае характерна диффузность поражения или множественность очагов. Кроме того, воспалительные изменения слизистой оболочки не ведут к той сглаженности рельефа, которая в большей степени свойственна раку.
Эрозии, участки ограниченного «омертвения» рельефа с небольшим углублением, втянутость по сравнению с окружающей слизистой оболочкой требуют дифференциации от поверхностных деструкций при гастритах и рубцов на месте ранее перенесенной язвы. При гастрите эрозии располагаются на вершине складок, ; а при раке как бы погружены в слизистую оболочку.
Визуальное отождествление этих изменений с тем или иным > процессом, как правило, крайне затруднено. Как и во всех перечисленных выше случаях, решающее значение принадлежит гастробиопсии, которая, по нашим данным, была результативного у всех больных с ранним раком желудка.
Общеизвестны трудности дифференциальной диагностики желудочных изъязвлений. Язвенная форма раннего рака желудка? эндоскопически представляется как язва, часто неправильной формы с асимметричной конвергенцией складок, односторонней ригидностью, неправильной цветовой гаммой. Злокачественная? язва нередко теряет характерный блеск, отмечается истончение- конвергирующих к краям язвы складок.
Учитывая трудность эндоскопической дифференцировк» доброкачественных изъязвлений желудка и язвенных форм раннего рака, которые составляют 60—70%, можно считать вполне оправданным предложение ряда авторов рассматривать любую» язву как злокачественную до тех пор, пока тщательное, нередко- повторное гастроскопическое исследование с обязательным морфологическим изучением биопсийного материала не позволит разрешить сомнения [Василенко X. В, и др. 1977]. При послеоперационном изучении «заживающих» язв доказано, что частота ма— лигнизации их достигает 10%.
Как свидетельствуют данные литературы и опыт МНИОЩ. тРУДН0Сти при выявлении раннего рака встречаются на всех этапах комплексного обследования. Точность эндоскопической визуальной диагностики недостаточно высока (20%), но часто имеет место предположительная диагностика (36%). В то же время точность гистологического исследования биопсийного материала составляет 91%, что подтверждает ведущее значение прицельного гастробиопсии при окончательном решении вопроса о злокачественности процесса. Именно поэтому при подозрении на ранний рак желудка следует производить биопсию не менее чем на
8—14 участках слизистой оболочки.
Необходимость множественной биопсии различных участков патологически измененной стенки желудка при гастрофиброско- пии объясняется тем, что нередко малигнизация происходит на фоне доброкачественного процесса, визуальные признаки мало выражены и элементы опухоли могут быть обнаружены лишь в? одном из биоптатов.
Множественная биопсия слизистой оболочки различных отделов желудка имеет большое практическое значение и для диагностики первично-множественных (мультицентрических) очагов? раннего рака желудка, которые, по современным данным, не представляют большой редкости.
Пробирки и флаконы, в которые помещают биоптаты, следует точно маркировать, ибо при операциях по поводу раннего рака? желудка уверенно идентифицировать расположение опухолевого очага практически не представляется возможным. В таких условиях хирургу приходится ориентироваться только на заключении эндоскописта и гистолога и выполнять операцию, не видя и на осязая саму опухоль.
О необходимости совершенно тонного обозначения участка ^биопсии свидетельствует и тот факт, что в удаленном препарате также бывает трудно найти участок, пораженный опухолью. Гистологам приходится исследовать весь желудок, что занимает много времени и сил. В одном из наших наблюдений не удалось обнаружить в удаленном препарате элементы злокачественной •опухоли, хотя в биоптате они были выявлены без сомнения. Мы склонны считать, что очаг малигнизации был настолько мал, что весь был удален при биопсии.
Оценивая реальные возможности дифференциальной диагностики раннего рака желудка можно сказать, что ни один из современных методов не лишен недостатков. Это заставляет нас прибегать к следующим тактическим схемам действия.
Если все исследования свидетельствуют о доброкачественной .патологии желудка, показано консервативное лечение с последующим гастрологическим контролем.
Если на основании данных, полученных одним из методов, можно предполагать злокачественный рост, то производят повторную гастроскопию с прицельной биопсией различных участков подозрительного на рак очага. При отрицательных данных гистологического контроля рекомендуется консервативное лечение в течение 1 мес с последующим гастрологическим контролем. При эффективности терапии показано динамическое наблюдение. В случае подтверждения- диагноза «рак», на любом этапе гастро- логического обследования должна быть проведена операция.
Если при цитологическом подтверждении опухоли не удается подтвердить диагноз гистологически, то при наличии предракового процесса (язва, полип) показана операция. В остальных случаях нужно продолжить динамическое наблюдение с регулярными повторными обследованиями.
В настоящее время основным методом лечения рака желудка. в том числе раннего, остается хирургический.
Однако вопрос об объеме операции окончательно не решен. Одни хирурги считают допустимой резекцию желудка в том же объеме, что и при язве или полипе, т. е. удаление 1/2—2/з органа и сохранение зон метастазировапия. По мнению других, методом выбора является субтотальная резекция желудка с обязательным удалением регионарных узлов единым блоком — традиционная .радикальная операция. Имеются также сторонники как экономных вмешательств на желудке (локальное иссечение) в комбинации с расширенной лимфаденэктомией, так и широких по объему вмешательств на желудке и ограниченных на лимфатических .путях.
Естественно, возникает вопрос, остается ли в силе лозунг 1Н. Н. Петрова: «Малый рак — большая операция»?
Основная трудность в выработке рациональной хирургической тактики для каждого больного состоит в том, что в настоящее время нет метода точного определения распространенности опухоли как по желудку, так и по лимфатическим путям во время операции.
В практике встречаются различные варианты, когда при небольшой по размерам опухоли имеются не только регионарные, но и отдаленные метастазы.
Увеличение размера опухоли свидетельствует о прогрессирующем течении заболевания. В большинстве случаев соотношение величины и распространенности новообразования имеет прямую связь. Однако этот признак не всегда отражает тенденцию рака к метастазированию. Так, в наблюдениях В. И. Пронина при опухоли диаметром до 1 см регионарных метастазов не обнаружено. При увеличении диаметра опухоли до 1,1—2 см метастазы выявлены у 7 из 19 больных, а до 2,1—3 см — у 4 из 13 больных. По нашим данным, из 46 больных раком желудка (опухоль диаметром до 1 см) регионарные метастазы обнаружены у одного.
Следует отметить, что не всегда метастазы отсутствуют при локализации опухоли только в пределах слизистой оболочки желудка. Не менее важно и то, что в целом при малом раке желудка в пределах слизистой оболочки приблизительно у каждого четвертого больного, а при инвазиях опухоли подслизистого слоя — у каждого третьего процесс распространяется в пределах лимфатического регионарного бассейна.
Й. Kitaoka и соавт. (1978) метастазы в лимфатических узлах при малом раке желудка обнаружили у 10%, К. Elster, Н. Tho- masko (1978)—в 2,3% больных. Н. Ohmura и соавт. (1978) в 1968—1975 гг. оперировали 168 больных раком с распространением опухоли в пределах слизистой оболочки желудка. Три года прожили 100% больных, не имевших метастазов, 66,7%—при поражении лимфатических узлов первого коллектора и 50% —узлов второго коллектора. Правда, не приводятся подробные данные о причине смерти больных. Среди них могли быть и умершие не от рака желудка. Таким образом, рак в пределах слизистой оболочки способен давать метастазы.
Хотя данные литературы показывают, что на определенном этапе процесс лимфогенного распространения рака может протекать только в области регионарного лимфатического аппарата и своевременная радикальная операция может привести к полному излечению, отдаленные результаты в этой группе наблюдений значительно хуже.
При операциях по поводу раннего рака желудка, почти как правило, не удается видеть опухоль, границы инфильтрации, поэтому приходится полностью полагаться на данные эндоскопического исследования. В наиболее трудном положении хирург оказывается в тех случаях, когда операция предпринимается по поводу микроскопического рака на фоне здоровой слизистой обо
лочки желудка или гастрита. Обычно патологические участки не определяются пальпаторно, не изменена и серозная оболочка.
Иногда во время операции мы выполняем гастроскопию, чтобы точно установить зону роста опухоли и наметить объем резекции желудка. Однако установление точных границ опухоли, которую и эндоскопист не всегда четко видит, представляет значительные трудности. Легче обстоит дело с выбором объема операции при малигнизированной язве или полипе. Их можно точно локализовать в определенном отделе желудка.
Выбор объема резекции желудка сложен и по той причине. что малый рак желудка может сопровождаться внутристеночными регионарными метастазами и мультифокальностью очагов поражения. Опухолевая трансформация соседних участков слизистой оболочки может возникать синхронно или метахронно. В этом отношении представляет интерес одно наше наблюдение. При морфологическом исследовании препарата желудка, резецированного по поводу язвы, обнаружены три участка малигнизациж как в язве, так и в соседних отделах слизистой оболочки. Очаги опухоли были диаметром не более 1 см и располагались на расстоянии 0,5—1,5 см друг от друга.
Подобное наблюдение не является единичным. Например, и® 26 больных ранним раком желудка, находившихся под наблюдением F. Paulino и A. Roselli (1979), у 2 отмечалась мультифо- кальность поражения, а еще у 2 большая опухоль сочеталась е другими очагами рака, но уже раннего. Возможно, что по мере дальнейшего изучения проблемы ранней онкологической патологии желудка выяснится, что опухолевые зачатки появляются сразу или в течение короткого времени, в «пределах опухолевого ноля», а затем, разрастаясь, сливаются в одну опухоль.
Первичная множественность опухоли у больных ранним раком желудка, по данным Kanai Tomoguki и соавт. (1973), выявлена в 7,7%, Wiendl (1976)— в 5,5%, Н. Kutaoka и соавт. (1978) в 7,75 % наблюдений. Прогноз у этих больных оказался самым неблагоприятным. Их необходимо в дальнейшем особенно тщательно наблюдать. Подобная особенность рака желудка объясняет то, почему хирурги опасаются выполнять экономные резекции даже при небольших опухолях.
Тем не менее постоянно появляются сообщения о признаках малигнизации в эндоскопически удаленных полипах. Последующее длительное наблюдение за этими больными показывает, что результаты таких вмешательств не всегда бывают плохими. Можно считать, что такой микроскопический рак был удален при биопсии полностью. Мы выполнили субтотальную проксимальную резекцию у больного, у которого при гастроскопии выявлен гипертрофический гастрит, а при множественной биопсии в одном из биоптатов слизистой оболочки проксимального отдела по малой кривизне на задней стенке найдена аденокарцинома. В удаленном препарате рака не обнаружено; отмечены картина дисплазии II степени, очаговый гастрит. По нашему мнению, участок малигнизации у этого больного был удален при биопсии.
Проблема лечения ранней онкологической патологии включает и выбор тактики при предраковых заболеваниях. Какова же она при язве желудка и полипах, если учесть, что они довольно часто малигнизируются?
Вероятно, тактика не может быть универсальной, так как во многом зависит не только от выявляемой патологии, но и от квалификации специалистов (эндоскопист, рентгенолог, морфолог, цитолог), способных в дальнейшем обеспечить грамотное наблюдение за больным, оснащенности лечебного учреждения необходимым для контроля оборудованием, возможности регулярного проведения диспансерных осмотров.
При язве желудка, недавно появившейся у больного старше 40-50 лет, при отсутствии после многократной биопсии данных о малигнизации, можно провести в течение 1—2 мес консервативное лечение. Однако не следует забывать, что при первичноязвенных формах рака также может наблюдаться эпителизация, создающая обманчивое впечатление излечения. Отсутствие в биоптате признаков малигнизации еще не означает, что язва доброкачественная. Например, в случаях, когда до операции предполагалось наличие доброкачественной язвы, лишь после гистологического .исследования (в одном из 14 фрагментов, взятых по краю язвы) поставлен диагноз рака [Paulino F. Roselli А. 1979].
Указанные обстоятельства оправдывают более активную хирургическую тактику при язве желудка. Предпочтение следует отдать субтотальной (в зависимости от расположения язвы), дистальной или проксимальной резекции желудка.
Можно сократить объем резекции желудка, но нельзя уменьшать границы лимфаденэктомии, о чем свидетельствует отечественная и зарубежная литература. Правда, Н. Oshibuchi и соавт, (1978) показали, что 5-летняя выживаемость у больных, оперированных по поводу рака, прорастающего мышечную оболочку, зависела в основном от степени инфильтративного роста, инвазии кровеносных и лимфатических сосудов. Размер же опухоли, степень поражения лимфатических узлов, глубина поражения мышечной оболочки не оказывали заметного влияния на отдаленные результаты.
А. А. Русанов (1976) считает необходимым шире ставить показания к хирургическому лечению язв желудка, В 10% наблюдений они малигнизируются. Подобную тактику поддерживает большинство хирургов.
Те же причины вынуждают к более радикальной тактике и при полипах, которые в последнее время чаще удаляют при фиб- рогастроскопии. Преимущества этого нетравматичного метода перед традиционными операциями очевидны. Однако отдаленные результаты изучены недостаточно. Имеющиеся данные противоречивы: по данным литературы, частота рецидивов рака колеблется от 17 до 70%.
Эндоскопические полипэктомии следует производить как можно чаще, ибо они способствуют своевременной диагностике рака желудка [Савельев В. С. и др. 1978; Kratochvil Р. et al. 1977].
Т. Otani и соавт. (1975) сообщают об интрамуральном введении этанола под визуальным контролем для лечения различных новообразований желудка, в том числе гиперпластических полипов, атипической гиперплазии и даже раннего рака. Необычность подобного подхода к лечению онкологической патологии не позволяет высказаться определенно о данном способе лечения.
Значительные трудности представляет выбор объема операции при малом раке, развившемся на фоне гастрита или в измененной слизистой оболочке, когда отсутствуют внешние признаки патологии. Органосохраняющие вмешательства в таких случаях особенно чреваты опасностью оставления очагов малигнизации, а следовательно, нерадикальностью лечения. Этим объясняются значительные различия показателей выживаемости.
Вероятно, указанные причины обусловили рецидив малого рака через 172—47г года после операции у 3 из 25 больных, находившихся под наблюдением В. Pedersen (1976). В то же время 13 больных живы без рецидивов 4—7 лет.
По данным F. Dobroschke и соавт. (1976), общая 5-летняя выживаемость без послеоперационной смертности при раннем раке желудка составила 86,5%, после радикальной субтотальной дистальной резекции с удалением сальников при поражении в пределах слизистой оболочки — 100%, при прорастании подслизистого слоя — 93 %. Значительно хуже результаты после проксимальной резекции, гастрэктомии и местного иссечения раннего рака (44,4%). Столь низкую 5-летнюю выживаемость можно объяснить наличием скрытых метастазов, которые не были удалены при операции.
При малом раке субтотальной резекции желудка отдают предпочтение большинство занимающихся этой проблемой [Kanai Т. et al. 1973; Elster К. Thomasko А. 1978. и др.].
Благодаря своевременной диагностике и рациональному объему операции (субтотальная резекция желудка с удалением регионарных лимфатических узлов) японским авторам удалось добиться 5-летней выживаемости в 94—96% случаев.
Таким образом, анализ современного опыта лечения раннег® рака желудка дает основание сделать вывод о существовании принципиально излечимых этапов развития заболевания. Своевременное выявление ранней онкологической патологии желудка — залог успешной профилактики и лечения рака. Имеются предпосылки для организации массового скрининга опухоли и значительного повышения выявляемое™ ранних форм опухоли. Эффективное и адекватное лечение ранней онкологической патологии открывает новые перспективы противораковой борьбы в нашей стране.
