Патология легких
6. ПОРОКИ РАЗВИТИЯ ЛЕГКИХ.
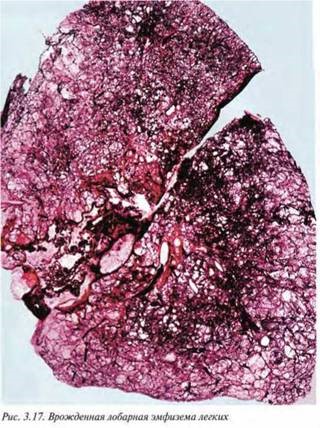
6.1. Врожденная лобарная эмфизема (Р25.0). Состояние возникает в связи с бронхиальной обструкцией, которая является исходом врожденного отсутствия хрящевой части бронха. Отсутствие хряща, которое может быть как локальным, так и диффузным, приводит к нестабильности стенки и ее коллапсу (рис.3.17). Этот процесс приводит к относительно нормальному вхождению воздуха на вдохе с его задержкой на выдохе и избыточно раздутым участком легкого. Клинически эта патология представлена дыхательной недостаточностью, развивающейся сразу после рождения или через несколько часов.
6.2. Легочная секвестрация (Q33.2). Патологический процесс связан с возникновением изолированного нефункционирующего участка легочной паренхимы, сохраняющего почти нормальную анатомическую структуру. Секвестрация чаще всего определяется в нижней левой доле легкого, однако иногда наблюдается эктопически: внутри и ниже диафрагмы, за паренхимой легких. Кровоснабжение такой массы аберрантное и происходит из аорты, подключичной или межреберных артерий.
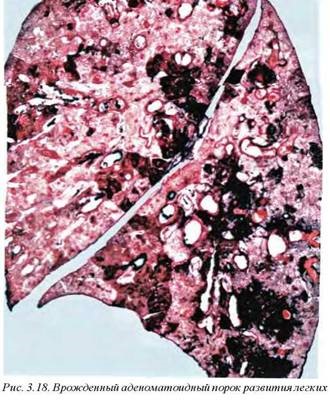
6.3. Врожденный аденоматоидный порок развития легких (Q33.9) часто ассоциируется с водянкой новорожденных (иммунной или неиммунной) и многоводием. Патологический процесс вызывает дыхательную недостаточность у новорожденных или рецидивирующую инфекцию у детей старшего возраста. Макроскопически представлен серо-белой, иногда серо-красной массой с множественными кистозными полостями, местами гомогенной паренхимой, иногда мелкозернистой на поверхности разреза (рис. 3.18).
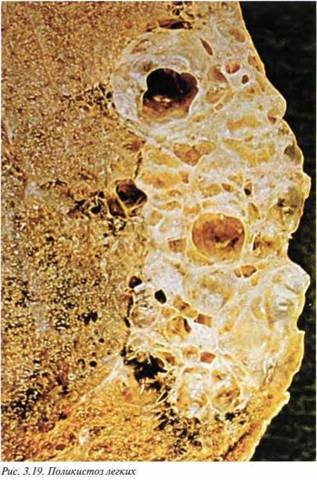
6.4. Бронхогенные кипы (Q33.0). Этот порок развития возникает из добавочных буллезно измененных альвеол, которые выстланы бронхиальным эпителием (рис. 3.19). Кисты могут быть солитарными или множественными и иногда ассоциируются с кистами печени и поджелудочной железы и почек, что указывает на возможный генетический характер их возникновения.
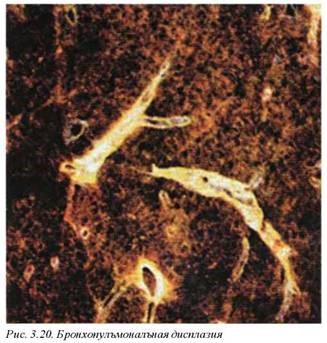
6.5. Бронхопульмональная дисплазия (Р27.1). Этот патологический процесс может быть визуализирован в легких новорожденных, у которых обнаруживалась клиника респираторной недостаточности. Этот кл и ни ко -анатомический симптомокомп лекс возникает у недоношенных, которые получали кислород и искусственную вентиляцию легких по поводу болезни гиалиновых мембран. В патогенезе играет роль некорректная организация поврежденного альвеолярного эпителия, что может быть связано с токсическим действием кислорода. Бронхопульмональная дисплазия вызывает хроническую легочную патологию у новорожденных. Клиническая картина болезни связана с бронхоспазмом и интерстициальным отеком легких.
Макроскопически легкие детей с бронхопульмональной дис плазией плотные, ателектатические, участки из всех отделов паренхимы тонут в воде. В острой фазе ткань легких напоминает печеночную паренхиму (рис. 3.20). Через 3—4 нед, если ребенок выживает в остром периоде, в легких с поверхности плевры определяются западающие и выступающие участки паренхимы, характеризующие неравномерность процессов организации. На разрезе паренхима легких плотная, пестрая,с выраженным фиброзом и множественными полями субплевральных и центральных ателектазов.
7. СОСУДИСТЫЕ БОЛЕЗНИ ЛЕГКИХ.
7.1. Легочная гипертония (127.0). Легочная циркуляция характеризуется большим объемом крови (идентичным системной циркуляции), низким давлением и низкой сосудистой резистентностью. Система адаптирована к увеличению кровотока при нагрузках за счет расширения сосудов и открытия анастомозов. Нормальная циркуляция в легких достаточно пассивна, поскольку зависит от пропульсивных характеристик правого и левого желудочков. Легочная гипертония определяется тогда, когда артериальное давление превышает сердечный выброс.
Известны две формы легочной гипертонии — первичная (идиопатическая) и вторичная.
Первичная (идиопатическая) легочная гипертония возникает преимущественно у женщин молодого и среднего возраста и характеризуется прогрессирующей одышкой, быстрым злокачественным курсом и приводит к смерти в 100% случаев. В литературе это состояние описывается как плексогенная гипертония, что связано со специфическими гистологическими характеристиками процесса. Высокая частота первичной легочной гипертонии отмечается у больных с HIV-йнфекцией.
Вторичная легочная гипертония встречается значительно чаще. Данная патология связана с уменьшением объема микроциркуляции с вовлечением артериол, капилляров или венул. Гипок- сия играет главенствующую роль в формировании вазоспазма за счет продукции активных вазоконстрикторов. Гипоксия является основным, а иногда и единственным фактором возникновения легочной гипертонии при хронических обструктивных и интерстициальных болезнях легких, кифосколиозе, ожирении, хронической высотной болезни и др. Другим фактором, оказывающим мощное влияние на продукцию локальных вазоконстрикторов, является ацидоз.
Интенсивная облитерация или обструкция также приводят к развитию легочной гипертонии, причем, однажды возникнув, легочная гипертония может только прогрессировать в той или иной степени, инициируя собственные процессы развития. Это вызывает вторичные сосудистые изменения легочного кровообращения, которые продолжают уменьшать объем легочной циркуляции. Повышение легочного венозного давления (посткапиллярная гипертония) может привести к развитию левожелудочковой недостаточности, как систолической, так и диастолической.
Редкой формой посткапиллярной гипертонии является вено окклюзивная болезнь, которая возникает у детей и молодых взрослых. Причина неизвестна, однако чаще всего с посткапиллярной гипертонией ассоциируются следующие состояния: вирусная инфекция, состояние после костномозговой трансплантации, состояние после химиотерапии, лейкемии и лимфомы, некоторые диссеминированные опухоли. Болезнь характеризуется прогрессирующей окклюзией венозного русла легких за счет фиброзной ткани с вторичным вовлечением артериальной части циркуляции. Макроскопически определяются фокальная легочная гиперемия, отек легких, легочные кровоизлияния и гемосидероз.
Другой причиной легочной гипертонии является потеря сосудистого русла в связи с легочной резекцией, васкулитом, болезнями соединительной ткани (в особенности ревматоидным артритом и системным склерозом).
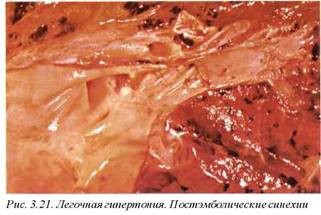
Обструкция микроциркуляторного русла возникает при тромбоэмболии (постэмболическая легочная гипертония), легочной микроэмболии, паразитарной инфекции (круглые черви), идиопатическом или вторичном тромбозе in situ. Классическим морфологическим симптомом постэмболической легочной гипертонии являются внутрисосудистые синехии как остатки организованных, часто бессимптомных тромбозов/тромбоэмболов (рис. 3.21).
Легочная гипертония может возникнуть и при ситуациях, увеличивающих венозное давление, однако, если речь идет о преимущественно функциональных изменениях, то интенсивность симптомов никогда не достигает классического уровня, и, естественно, гипертония является обратимой. Сюда относятся констриктивный перикардит и тампонада полости перикарда, митральный стеноз, миксома сердца, инфильтративные болезни средостения. Более редкими причинами клинически и морфологически выраженной легочной гипертонии являются внутрисердечный шунт слева направо, гипоксическая полицитемия, ассоциированная портальная гипертония.
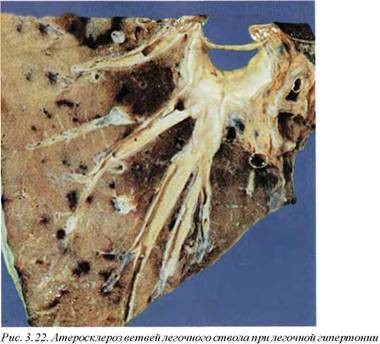
Макроскопически при любой форме легочной гипертонии обнаруживается расширение системы легочных артерий, что определяется при сравнении их диаметра с диаметром соответствующего бронха, и атеросклероз артериальной легочной системы, чаще всего в стадии липидных пятен и фиброзных бляшек (рис. 3.22), поскольку больные обычно не доживают до формирования полных атером.
7.2. Легочные тромбоэмболии и инфаркты (126.9). Термин «легочная эмболия» обычно подразумевает легочную тромбоэмболию, которая является наиболее частой и тяжелой формой данной патологии. Это потенциально смертельное состояние, возникающее как осложнение периферического и реже центрального тромбоза (хотя описаны случаи идиопатической тромбоэмболии). Последнее, вероятно, не совсем корректно отражает патологический процесс, поскольку такие случаи могут наблюдаться при полном отрыве эмбологенного венозного тромба, хотя идиопатические тромбоэмболии также не исключены.
В США легочная тромбоэмболия является непосредственной причиной смерти в более чем 50 000 случаев в год и одной из наиболее частых причин смерти среди госпитализированных больных.
Однако достоверно частоту легочной эмболии определить не представляется возможным, поскольку клинически она проявляется только в 15% всех случаев, из которых истинная клиническая картина легочной тромбоэмболии в виде острого или острейшего легочного сердца или обструктивного шока наблюдается в 40%.
По данным литературы, даже исследование фиксированного и раздутого легкого на тонких серийных срезах позволяет выявить остаточные изменения, характерные для перенесенной тромбоэмболии и тромбоза у 70% всех умерших. Другие эмболические синдромы с вовлечением легочного артериального русла представлены жировой эмболией, эмболией околоплодными водами, эмболией инородными телами (тальк), септической и паразитарной эмболией, эмболией опухолевыми клетками (характерна для почечно-клеточного рака).
Наиболее частой локализацией эмбологенных тромбов являются нижние конечности и крупные вены таза, реже полости сердца. В некоторых случаях источник легочной тромбоэмболии определить невозможно. Примерно у 50% лиц с глубокими венозными тромбозами можно прижизненно или посмертно выявить симптоматику перенесенной легочной тромбоэмболии, и в 75% случаев легочной тромбоэмболии можно установить наличие периферического венозного тромбоза.
Периферический эмбологенный тромбоз и легочная тромбоэмболия являются клинико-анатомическим проявлением одного и того же заболевания — венозного тромбоза. Факторы риска в классическом варианте связаны с венозным стазом, нарушением коагуляционных систем и повреждением интимы. Венозный стаз увеличивается при неподвижности, ожирении, повышении центрального венозного давления. Повреждение сосудов возникает при предшествующих тромбозах, ортопедической хирургии и травме. Гиперкоагуляционный синдром наблюдается при приеме ряда медикаментов (пероральные контрацептивы, стероиды, антикоагулянты) или при некоторых заболеваниях (патология сердца и сосудов, злокачественные опухоли, послеоперационный статус и др.). Такие врожденные состояния как дефицит протеинов С, S и антитромбина III проявляются гиперкоагуляционным синдромом.
В патофизиологии легочной эмболии присутствуют множественные эффекты. Физическая обструкция сосудистого русла и вазоконстрикция в связи с развитием нейрогуморальных рефлексов вызывают увеличение сосудистой резистентности. Массивная легочная тромбоэмболия приводит к острому или острейшему легочному сердцу. Васкулярная обструкция увеличивает мертвое пространство и ведет к гипоксии в связи с развитием шунта справа налево, снижением сердечного выброса и сурфактантзависимыми ателектазами. Развивающаяся бронхоконстрикция приводит к нарушению функции внешнего дыхания.
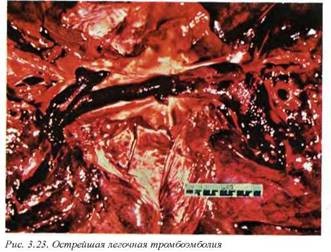
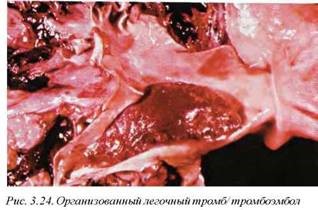
Массивные легочные эмболии обычно сопровождаются системными симптомами и не приводят к развитию легочных инфарктов. Если больной выживает, то тромбоэмбол в системе легочной артерии подвергается обычному процессу организации (рис. 3.23, 3.24). Возникновение паренхиматозных инфарктов более характерно для мелких и немассивных эмболии, вовлекающих менее 15% легочной циркуляции, и с уменьшением объема тромба/тромбоэмбола частота инфарктов увеличивается.
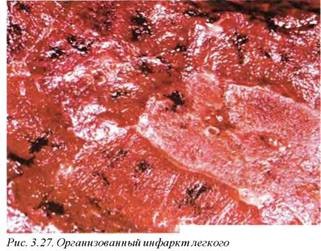
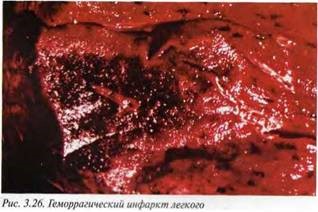
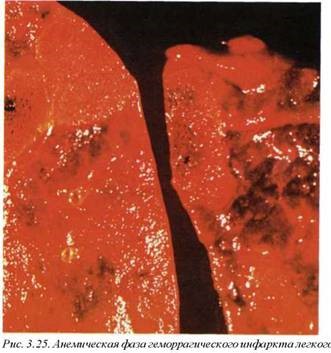
Макроскопически инфаркт легкого в начальной (анемической) фазе развития (рис. 3.25) имеет треугольную форму, затем в связи с перфузией крови в очаг анемии и выравниванием давления он приобретает классический геморрагический вид (рис. 3.26). И нфаркты четко отграничены от прилежащей паренхимы, гомогенные, мелкозернистые, темно-красного цвета. Их локализация обычно субплевральная, направленная верхушкой к корню легкого. Исходами легочного инфаркта являются организация и развитие пневмонии и абсцесса (рис. 3.27), плеврит с возникновением плевральных сращений, формирование псевдокисты.
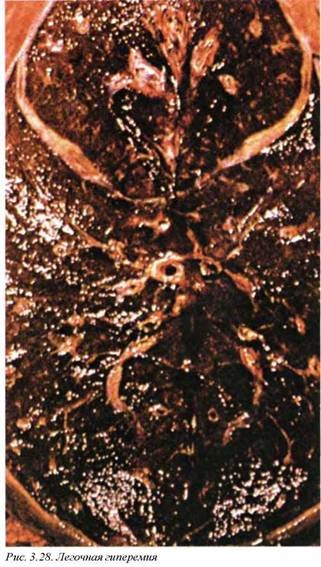
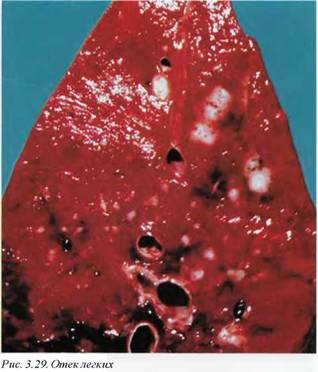
7.3. Легочная гиперемия и отек легких (J81). Основной причиной развития отека легких с транссудацией жидкой части крови в альвеолярные пространства является левожелудочковая недостаточность, которая приводит к повышению капиллярного гидростатического давления. Массивная инфузионная терапия кристаллоидами при неадекватном диурезе может явиться причиной ятрогенного отека легких. Однако при сохранении адекватного уровня лимфатического дренажа отек легких при гиперинфузи онных синдромах не развивается. Настоящее положение относится к так называемому кардиогенному отеку легких, развитие которого связано с центральными механизмами.
Макроскопически масса легких значительно увеличена, паренхима плотноватая, эластическая, безвоздушная, гомогенная, серо-красная. С поверхности разреза стекает пенистая жидкость (рис. 3.28, 3.29).
Некардиогенный отек легких связан с выраженным нарушением проницаемости капилляров с последующей диффузией жидкой части крови в альвеолярное пространство. Наиболее классическим примером настоящей патологии является синдром шокового легкого (в американской литературе можно встретить синоним — взрослый тип респираторного дистрессйиндрома; детский тип связан с недостаточностью сурфактанта у недоношенных новорожденных).
Шоковое легкое (J80), являясь одним из основных клинико анатомических проявлений шока, возникает, кроме того, и при выраженном снижении легочной перфузии в послеоперационном периоде, при септицемии, панкреатите, ожогах, легочной инфекции, токсическом действии кислорода, прямых легочных токсинов и ирритантов, анафилаксии, травме и др. В настоящее время обращается внимание на роль кислородной терапии в лечении этих состояний. Токсическое действие свободных радикалов (супероксидов и гидроксидов) приводит к прямому повреждению альвеолярной стенки и базальной мембраны. Развившийся в последующем отек сочетается с альвеолярными ателектазами и кол лабированием паренхимы.
В патогенезе нарушений гемоперфузии большое место занимает патология легочной микроциркуляции. Прямое васкулярное повреждение отмечается в случае, когда образующиеся тром боцитарные микротромбы, сладжи и секвестрированные нейтро филы начинают влиять на функцию и морфологию капилляров. Как результат констрикции легочной микроциркуляции возникает локальное шунтирование кровотока из очагов повреждения и тканевой ацидоз.
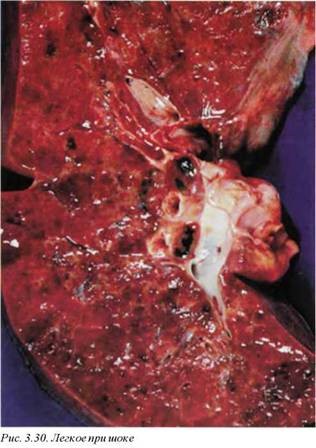
Легочную гиперемию можно наблюдать как классический синдром при митральных стенозах или других состояниях, повышающих конечно-диастолическое давление и центральное венозное давление.
Макроскопически определяется изменение окраски легких, преимущественно в сторону темно-красного или темно-синего цвета с черно-коричневыми участками, что связано с возникновением фокусов гемосидероза (рис. 3.30).
7.4. Вено-окклюзивные болезни легких (128). Эта группа болезней характерна для детей преимущественно в возрасте до 18 мес, но иногда встречается у более старших детей и даже взрослых. Основой болезни является развитие распространенного тромбоза легочных вен с реканализацией либо без таковой.
Этиология заболевания неизвестна, в настоящее время определенное значение придается легочной инфекции и иммунологическим синдромам. Клинически определяются выраженная легочная гипертония, правожелудочковая гипертрофия или гипертрофия/дилатация, расширенные легочные артерии с явлениями атеросклероза. Макроскопически обнаруживаются полиморфные неспецифические изменения в легких, представленные гиперемией, отеком, интерстициальным фиброзом, гемосидерозом и лимфангиоэктазией.
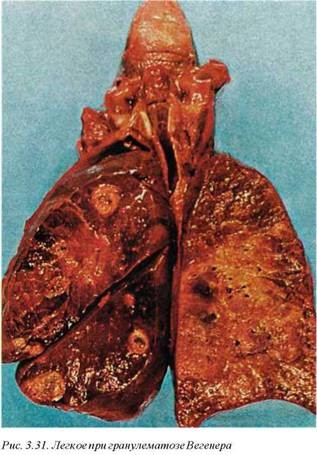
7.5. Патологические изменения в легких отмечаются при легочных васкулитах и наиболе активно бывают выражены при гранулематозе Вегенера (рис. 3.31), являясь в этом случае патогно моничным симптомом. При этом обнаруживаются распространенные некротические гранулемы, которые, сливаясь, приводят к образованию полостей. Изолированный процесс в легких встречается редко и в основном сочетается с поражением верхних дыхательных путей и придаточных пазух носа. Легочные симптомы или легочные васкулиты могут иметь клиническое значение при болезни Шарга—Штрауса и узловатом панартериите. При этих состояниях диагноз устанавливается на основании клинической картины, иммуологического исследования крови и гистологического материала. Макроскопические изменения в легких могут быть выражены незначительно или вообще отсутствовать.
8. ВОСПАЛИТЕЛЬНЫЕ БОЛЕЗНИ ЛЕГКИХ.
8.1.1 Острый бронхит (J20.9; при установлении агента следует использовать дополнительные рубрики). Процесс поражает главным образом крупные бронхи. Этиологические факторы в основном представлены вирусами (миксо и парамиксовирусы, респираторно-синцитиальный вирус, вирусы гриппа, аденовирусы), бактериями (стафилококки, стрептококки, Haemophilus influenza), ирритантные пыли и газы. Макроскопически в слизистой определяется гиперемия с участками кровоизлияний, в тяжелых случаях — эрозивные процессы и изъязвления.
Многие бронхиты не являются инфекционными и связаны с физическими факторами воздействия (химические ирританты, аспирационный синдром, радиационные поражения). Макроскопическая картина их в основном неспецифична, но иногда обнаруживает зависимость от этиологического фактора. Так, язвенные процессы более характерны для ирритантов и прямых токсических субстанций, геморрагический компонент интенсивно выражен при ожогах.
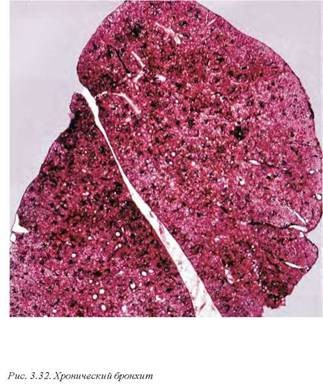
8.1.2. Хронический бронхит (J42) (рис. 3.32). Процесс возникает как ответ на длительное воздействие бронхиальных ирри- тантов. Поскольку большое значение в патогенезе и клинике заболевания придается обструкции верхних дыхательных путей, в настоящее время хронический бронхит рассматривается как часть хронического обструктивного заболевания легких (также см. разд. 10 настоящей главы «Хронические обструктивные болезни легких»).
8.2. Бронхиальная астма (J45). В основе патологического процесса лежит хроническое воспаление мелких бронхов и бронхиол, которое характеризуется их гиперчувствительностью к различным субстанциям с последующей констрикцией и отеком.
Известны две формы бронхиальной астмы, которые могут сосуществовать у одного больного: аллергическая и неаллергическая.
Аллергическая астма является типичным воспалительным заболеванием, возникновение которого связано с иммунологическими механизмами. Симптомы наблюдаются при развитии 1 го типа иммунологической реакции, инициированного иммуноглобулином Е, которая, в свою очередь, связана с ингаляцией аллергенов. Факторы, способствующие возникновению и развитию аллергической астмы, чрезвычайно разнообразны: практически любой аллерген — бактериальные протеины, медикаменты, органические и неорганические вещества и т.д. — может вызвать вышеуказанную реакцию.
Неаллергаческая астма не имеет общепринятой этиологической гипотезы. Симптомы возникают при воздействии неаллер газирующих факторов, таких как физические нагрузки или психоэмоциональный стресс.
Клинические проявления вариабельны: от внешне бессимптомных мелкопузырчатых хрипов до пароксизмов одышки и дыхательной недостаточности. Одним из тяжелых и угрожающих осложнений астмы является астматический статус, характеризующийся резистентностью к бронхолитикам, непродуктивным кашлем, нарастанием бронхиальной обструкции, развитием гипоксии и гиперкапнии.
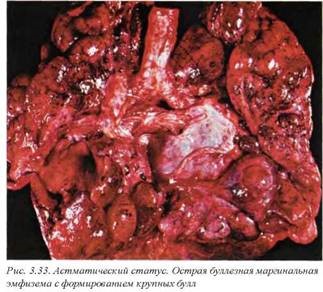
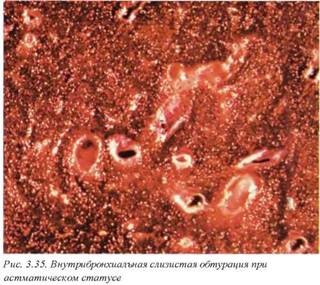
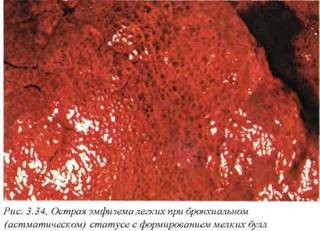
Макроскопические изменения вне астматического статуса при неосложненных формах заболевания могут не выявляться либо быть неспецифическими, в связи с чем постановка диагноза требует детального изучения истории болезни и обязательного присутствия клинициста во время вскрытия. При бронхиальном (астматическом) статусе определяются множественные участки острой эмфиземы, низкая диафрагма, раздутые легкие, которые при вскрытии грудной полости закрывают переднее средостение (рис. 3.33, 3.34). Мелкие бронхи заполнены вязкой мокротой, формирующей обтурирующие пробки (рис. 3.35).
8.3. Инфекционные пневмонии. Инфекционная пневмония у взрослых обычно бактериальная, у детей и лиц переходного возраста — вирусная или микоплазменная. У лиц с ослабленП ным иммунитетом (злокачественные новообразования, химиотерапия, иммуносупрессивная терапия, иммунодефицита) определяются нетипичные возбудители, такие как Haemophilus capsulatum, семейства Candida и Actinomyces или Pneumocyst carinii. Бактериальные агенты обычно вызывают истинную пневмонию, связанную с возникновением внутриальвеолярного воспаления, тогда как вирусы и микоплазма имеют тенденцию к развитию интерстициального воспаления и вызывают пневмонит. Несмотря на это, термин «пневмония» закрепился за обоими состояниями.
Терминология воспалительного процесса зависит от интенсивности распространения воспаления: сегментарное, лобулярное, лобарное и т.д. Если источник инфекции локализуется в бронхе и окружающей паренхиме равномерно, следует говорить о бронхопневмонии.
8.3.1. Бактериальные пневмонии (возможно использование множественных рубрик). Чаще всего возбудителем бактериальных пневмоний выступает Streptococcus pneumonia (J 13). В классическом варианте в процесс вовлекается только одна доля легкого.
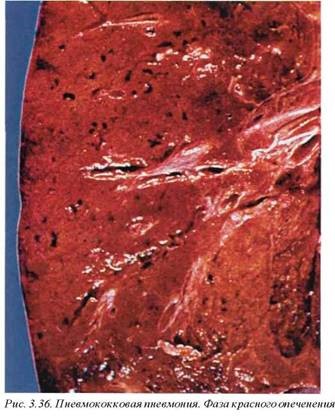
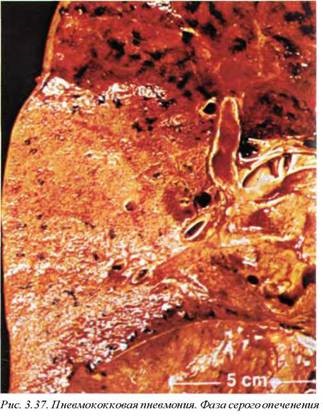
Традиционно описывается четыре фазы динамического развития пневмококковой пневмонии: фаза прилива, красного опе- ченения (рис. 3.36), серого опеченения (рис. 3.37) и фаза разрешения. Ранее данная форма пневмонии достаточно часто встречалась в различных контингентах, однако в связи с широким применением пневмококковой вакцины в настоящее время эта патология наблюдается в основном у алкоголиков и ослабленных лиц, особенно с недостаточностью питания.
Бактериальные пневмонии довольно часто бывают вторичными и осложняют течение травмы, кровотечения, гиповолемического шока, легочных инфарктов и являются паранеопласти ческим процессом. В некоторых случаях бактериальный компонент с возникновением воспалительного экссудата в альвеолах является следствием интерстициальной пневмонии (пневмонита) или прямого токсического повреждения легких.
При работе с умершими, у которых клинически или макроскопически обнаруживается воспаление легочной паренхимы, следует придерживаться соответствующего протокола. Важно не только определить морфологические критерии пневмонии и их клинико-анатомическое значение в танатогенезе, но и выявить возбудитель и его чувствительность к проведенной антибактериальной терапии.
В табл. 3.1 приведены сведения о пневмониях, отражающие особенности возбудителя, типичную клиническую и рентгенологическую симптоматику и наиболее вероятные осложнения.
8.3.2. Бронхопневмонии (Л 8.0). При бронхопневмонии в паренхиме легких наблюдаются очаговые морфологические изменения в виде плотных сухих пестрых очагов, расположенных пе рибронхиально. На разрезе участки пневмонии мелкозернистые, из соответствующих бронхов выделяется гной. Бронхопневмония вызывается такими бактериальными возбудителями как Staphylococcus aureus, Pseudomonas, Proteus, Klebsiella и другими Г(—) колиформными бактериями.
Некоторые из перечисленных бактерий вызывают бронхопневмонии в госпитальных условиях. Госпитальные пневмонии рассматриваются как выявленные инфекции легких, возникшие не ранее 48 ч после поступления больного в стационар. Бронхопневмонии стафилококкового генеза чаще осложняются абсцедированием, эмпиемой, пиопневмотораксом и сепсисом.
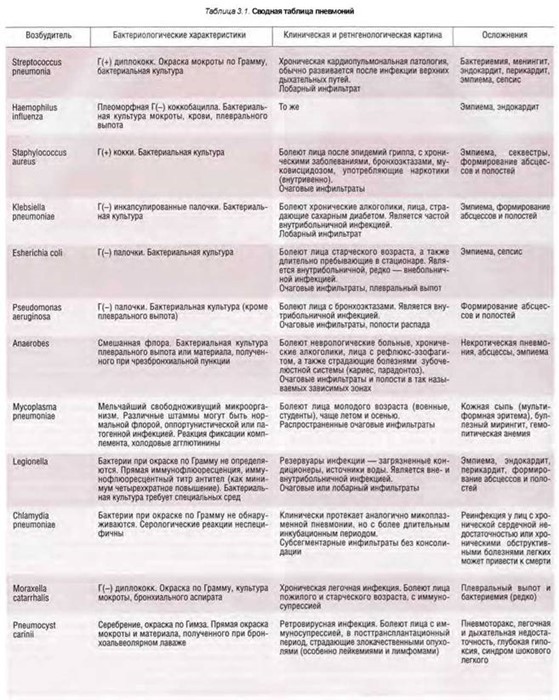
8.3.3. Ингерстиниальные пневмонии (J84.9; при идентификации возбудителя следует использовать дополнительные нозологические рубрики) обычно имеют вирусное происхождение (респираторно синцитиальный вирус, адено, миксо и парами ксовирусы). Настоящая форма легочного воспаления часто наблюдается у лиц с иммуносупрессией и вызывается у них более редкими возбудителями, такими как цитомегаловирус, вирусы простого герпеса и кори. В патогенезе интерстициальных пневмоний большое место занимают предшествующие патологические процессы, такие, например, как ателектазы. Обычно вирус воздействует на слизистую терминальных бронхиол и собственно паренхиму легких непосредственно, а не через гематогенную диссеминацию. Последняя может возникать в ходе течения интерстициальной пневмонии, однако редко является истинным путем вовлечения легких.
Макроскопически интерстициальные пневмонии не имеют специфической симптоматики. Паренхима легких очагово лотная, местами вне определенной локализации наблюдаются выраженная консолидация и ателектазы (рис. 3.38). Основной патологический процесс локализуется в межуточной ткани. При разрезе легких может определяться характерный скребущий звук.
Существует множество различных терминов, характеризующих интерстициальную пневмонию или пневмонит, в основе систематизации которых лежат как клинические, так и морфологические симптомы.
Так, для обозначения интерстициальной пневмонии с быст ропрогрессирующим течением некоторые авторы используют термин «синдром Хаммана—Рича» (см. также разд. 11 настоящей главы «Интерстициальные болезни легких»). Другие авторы выделяют диффузный фиброзирующий альвеолит, десквамативную и лимфоидную формы интерстициальной пневмонии.
Макроскопические изменения в легких неспецифичны, слабо выражены или вообще отсутствуют. Диагностика этой группы патологических процессов без знания полной клинической картины и применения специальных и микроскопических методов исследования невозможна.
Тяжелые вирусные пневмонии могут привести к синдрому шокового легкого несколько чаще, чем бактериальные.
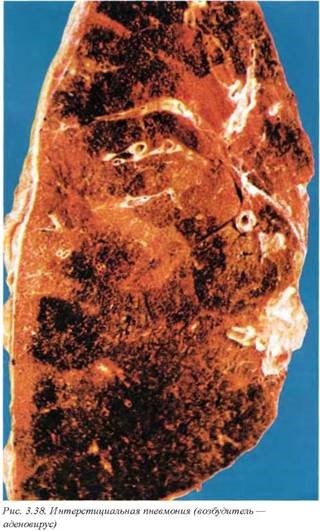
8.3.4. Атипичные пневмонии. Обычно возбудителями атипичных пневмоний являются Legionella (A48.1), семейства MycoplasD mae (J15.7) и Chlamydiae (J16.0). Этой формой пневмонии в основном болеют дети и молодые взрослые.
Первичные атипичные пневмонии являются интерстици альными с явлениями бронхиолита, эрозивного дистального бронхита. Они были названы атипическими, поскольку типичный экссудат и консолидация легочной паренхимы, столь очевидные при бактериальной или бронхопневмонии, отсутствуют. Атипичные пневмонии (пневмониты) сопровождаются высоким титром Холодовых антител (агглютинирующие антитела, которые реагируют при 4—6°С), что приводит к развитию эритроцитарных агглютинатов.
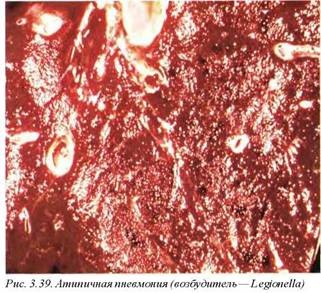
Макроскопически определяется неравномерное кровенаполнение легочной паренхимы, которое сопровождается развитием мелких субплевральных пластинчатых ателектазов (рис. 3.39). Однако при тяжелых легионеллезных пневмониях у курильщиков с длительным анамнезом хронического бронхита макроскопическая картина может напоминать лобарную бактериальную пневмонию. Дифференциальная диагностика основана на пестрой окраске патологического процесса при атипичной пневмонии и гомогенной — при бактериальной (цвет консолидации определяется фазой развития воспаления).
8.4. Неинфекиионные пневмонии встречаются достаточно часто и могут быть осложнены вторичной или оппортунистической инфекцией.
8.4.1. Аспирационный синдром (Т17.9). Аспирация кислотного материала, особенно при рН менее 2,5, в трахеобронхиальное дерево приводит к формированию различных патологических процессов. В связи с химическими характеристиками аспирата выделяется несколько форм аспирационного синдрома, которые имеют достаточно четкие отличительные особенности.
Аспирация инертного материала (кровь). В данном случае аспирационный синдром протекает в виде асфиксии, особенно, если нарушен нормальный кашлевой рефлекс (рис. 3.40). При своевременном лечении прогноз благоприятный.
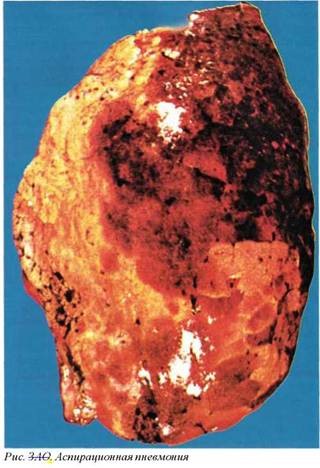
Аспирация токсического материала. Данный вид аспирационного синдрома протекает как аспирационная пневмония. Обычно прямое действие на легкие оказывают гидрокарбоны (бензин и аналогичные соединения), которые могут аспириро- ваться как первично, так и в сочетании с аспирацией рвотных масс. Поскольку кислое содержимое желудка более агрессивно, макроскопические изменения соответствуют стандартной картине аспирационной пневмонии.
Аспирация пищевых масс. Этот вид аспирационного синдрома развивается при нарушении глотания, жевания, у лиц с зубными протезами, неврологических больных и т.д. Следует установить предшествующее употребление больными алкоголя или седативных препаратов.
СиндромМендельсона (острая аспирация желудочного содержимого). Интенсивность легочного повреждения прямо зависит от количества и рН аспирата. Аспирация чистого желудочного сока приводит с некротическому бронхиолиту и легочному геморрагическому синдрому. Синдром Мендельсона является одной из наиболее частых причин развития шокового легкого.
Хроническая аспирация желудочного содержимого. В большинстве случаев этот вид аспирационного синдрома связан с патологией пищевода (кардиоспазм, стриктуры, опухоли, склеродерма) и рассматривается как проявление тяжелого гастроэзофагального рефлюкса. Начальные изменения в легких неспецифичны, в более отдаленных стадиях обнаруживаются неаллергическая бронхиальная астма, бронхоэктазы и прогрессирующий легочный фиброз.
Задержка аспирата в трахеобронхиальном дереве приводит к развитию рецидивирующих пневмоний, бронхоэктазов," абсцессов легких, ателектазов и постобструктивной эмфиземы.
Макроскопически определяется поражение так называемых зависимых зон легкого: нижних отделов верхних долей и верхних отделов нижних долей, т.е. патологические изменения локализуются в области междолевой борозды. Легкое на разрезе плотное, пестрое, в трахеобронхиальном дереве определяется кровавая мокрота, эрозивно-некротический трахеобронхит, перибронхиальные кровоизлияния. При присоединении вторичной инфекции возникают сливающиеся зоны нагноения и острого абсцедирования. Общими морфологическими находками при аспирационном синдроме является легочная гиперемия и некардиогенный отек легких.
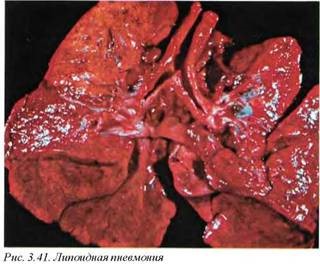
8.4.2. Липоидная пневмония (J69.1). Данный вид неинфекционного воспаления является результатом аспирации небольших количеств масел, что приводит к консолидации легочной паренхимы (рис. 3.41).
8.4.3. Гемморратические пневмонипы (М31.0) ассоциируются с интерстициальными пневмонитами и легочными кровотечениями.
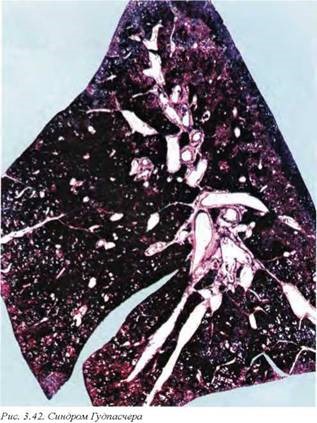
Диффузный альвеолярный геморрагический синдром может быть проявлением разнообразных иммунных и неиммунных заболеваний. Причинами иммунного альвеолярного геморрагического синдрома являются синдром Гудпасчера, васкулиты и аутоиммунные болезни соединительной ткани, системный некротический васкулит, быстропрогрессирующий гломерулонефрит. Неиммунные причины включают коагулопатию, митральный стеноз, некротическую легочную инфекцию с внутрисосудистой инвазией, побочный эффект некоторых лекарственных средств и идиопатический легочный фиброз.
Синдром Гудпасчера характеризуется рецидивирующими легочными кровотечениями в сочетании с быстропрогрессирующим гломерулонефритом (см. гл. 6 «Клиническая патология почек и моче выводящих путей»). Этиология болезни связана с циркуляцией антител к базальным мембранам легких и почек. Заболевание возникает чаще у мужчин в среднем возрасте (30—40 лет). Кровохарканье и легочное кровотечение — более явный синдром, чем собственно альвеолярные геморрагии (рис. 3.42). Диагноз устанавливается на основании характерного рисунка иммунофлюоресценции в гистологических препаратах (линейные депозиты IgG) и определения антител к базальным мембранам в сыворотке крови.
Идиопатическийлегочный гемосидероз является заболеванием детей и подростков и характеризуется рецидивирующими легочными кровоизлияниями. В отличие от синдрома Гудпасчера иммунологический рисунок болезни и патология почек не определяются.
Макроскопически оба патологических процесса имеют не специфическую морфологическую картину, представленную пестрой окраской легких с множественными кровоизлияниями различной степени организации.
8.4.4. Эозинофильная пневмония (J82) характеризуется периферической эозинофилией, эозинофильной инфильтрацией легких и бронхопневмонией различной распространенности в сочетании с отеком легких. Макроскопические изменения неспецифические, и диагноз устанавливается на основании клинико-лабораторной картины и гистологического исследования. Эозинофильная пневмония является компонентом синдрома Леффлера, который также характеризуется некротизирующим ангиитом,
формированием гранулем и интерстициальным пневмонитом. Другими причинами эозинофильного легочного синдрома являются паразитарные инфекции, реакции гиперчувствительности и узловатый панартериит.
8.4.5. Гиперсенситвные (гиперчувстсвительные) пневмонипы (J67) являются группой заболеваний с единым иммунозависимым патогенезом и возникновением интерстициального гранулематозного воспаления. Легкие фермера — наиболее типичный случай интерстициального пневмонита. Этиологическим фактором данного заболевания является флора заплесневелого сена и листьев (споры термофильных актиномицетов). Начальные изменения выявляются только на микроскопическом уровне, в последующем в легких обнаруживается облитерирующий альвеолит и диффузный легочный фиброз.
8.5. Нагноительные заболевания легких.
8.5.1. Бронхоэктазы (J47) проявляются постоянным и необратимым расширением бронхиального дерева в ассоциации с гнойным острым или хроническим воспалением. В патологический процесс чаще вовлекаются нижние доли легких. Бронхоэктазы часто наблюдаются как проявление иммобильного цилиарного синдрома (болезнь Картагенера) и муковисцидоза. Многие вирусные инфекции, сопровождающиеся острым бронхитом, также являются причиной бронхоэктазов, хотя и реже.
В некоторых литературных источниках бронхоэктазы сочетаются с хронической обструктивной болезнью легких или приобретают самостоятельную нозологическую интерпретацию в качестве бронхоэктатической болезни.
Развитие бронхоэктаза предполагает сочетание перибронхиального фиброза, слабость бронхиальной стенки в связи с воспалением и нарушение функции внешнего дыхания (обструкция дыхательных путей на определенном уровне). Присоединение хронической инфекции с формированием дренированных и недренированных бронхиальных абсцессов приводит к трансформации бронхоэктазов в бронхоэктатическую болезнь.
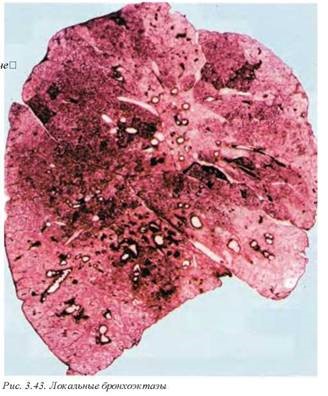
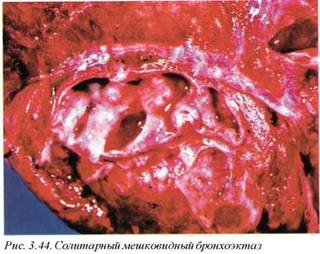
Макроскопически определяются очаговые расширения бронхов, заполненные бронхиальной слизью с явлениями нагноения (мешковидные бронхоэктазы), которые могут быть полностью отделенными от просвета бронха и фактически представлять собой абсцессы (рис. 3.43). Цилиндрические бронхоэктазы выявляются при продольном вскрытии бронхиального дерева, при этом обнаруживается, что крупные бронхи оканчиваются практически субплеврально (рис. 3.44). Такие бронхоэктазы не содержат большого количества воспалительного экссудата в связи с постоянным дренированием их. По периферии бронхоэктазов обычно развивается бронхопневмония и очаговый пневмофиброз, а при длительном течении — цирроз легкого.
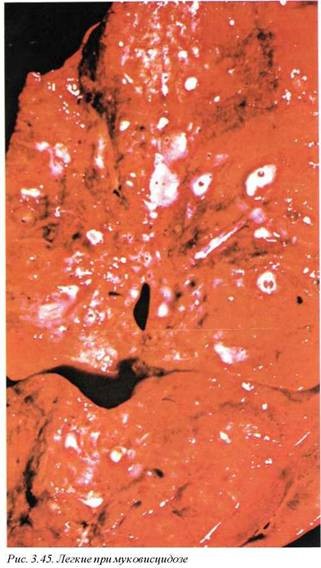
В настоящее время наиболее частой причиной развития бронхоэктазов является муковисцидоз, который обнаруживается приблизительно в 50% всех наблюдений (рис. 3.45). Густая вязкая гиперпродуцируемая слизь создает условия для обтурации трахеобронхиального дерева, а патологические процессы слизистой приводят к нарушению кашлевой функции реснитчатого эпителия.
8.5.2. Абсцессы легких (J85) определяются как зоны очагового нагноения паренхимы. Могут возникать в связи с развитием брон- хоэктазов, лобарной или бронхопневмонии, аспирации желудочного содержимого или другого инородного материала, а также септицемии.
Макроскопически абсцессы можно подразделить на дренированные, недренированные и эмболические.

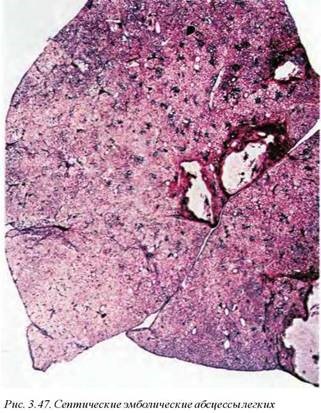
Дренированные абсцессы сообщаются с бронхом и представлены полостями различного размера с серо-коричневой мелкозернистой внутренней поверхностью. Для хронических абсцессов характерно интенсивное фиброзное капсулообразование. В острых абсцессах формирование стенки не выражено, полость абсцесса отделена от паренхимы консолидированной воспаленной тканью. Недренированные абсцессы представляют собой фокусы интенсивной консолидации и гнойной инфильтрации паренхимы с центральным распадом (рис. 3.46). Для эмболических абсцессов специфичным является наличие множественных фокусов нагноения, нередко в различных стадиях развития (рис. 3.47). Кистовидные полости, заполнены гноем различной консистенции и цвета, что определяется длительностью их существования и характером гноеродной флоры.
8.6. Инфекционные гранулемы легких.
8.6.1. Первичный легочный туберкулез (А15). Первичный легочный туберкулез продолжает быть одной из наиболее распространенных причин заболеваемости и смертности во всем мире, хотя следует отметить, что положение по сравнению с прошлым значительно улучшилось. В настоящее время этот процесс стал встречаться в развитых странах реже, особенно в виде запущенных и высококонтагиозных форм. Однако в странах третьего мира проблема легочного туберкулеза продолжает носить как медицинский, так и социальный характер.
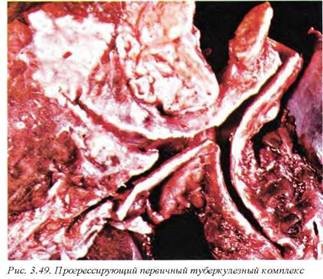
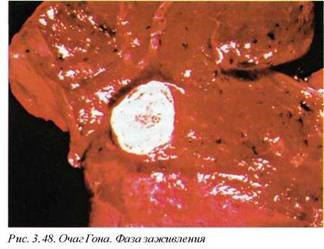
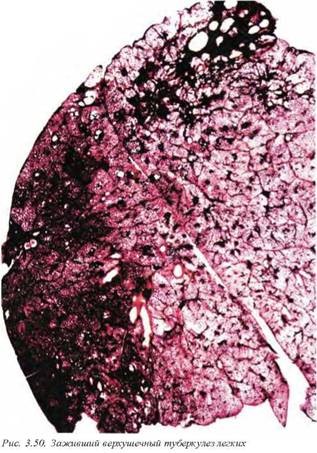
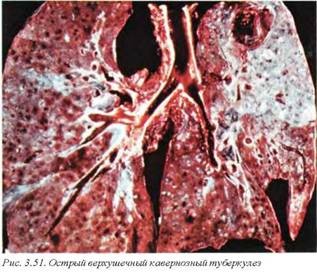
Причина туберкулеза связана с инфицированием Mycobacterium tuberculosis. Первичный туберкулезный комплекс (комплекс Гона) представлен собственно очагом Гона, туберкулезным лимфаденитом и туберкулезным лимфангитом (рис. 3.48). Очаг Гона локализуется субплеврально и обнаруживается либо в нижних сегментах верхней доли, либо в верхних сегментах нижней доли. Может наблюдаться как прогрессирование (рис.3.49), так и заживление (рис. 3.50) очагов первичного туберкулезного комплекса. Очаг Гона, как и другие макроскопически видимые легочные гранулемы, характеризуется выраженным центральным некрозом, который имеет специфический казеозный вид (серо-белые хрупкие творожистые массы). Чаще всего вовлекаются верхушки легких, особенно в активную фазу болезни (рис. 3.51), однако процесс может захватить и нижние доли или иметь любую другую локализацию, правда, реже.
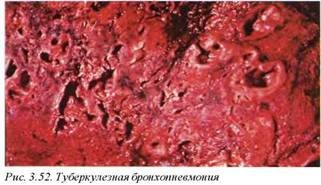
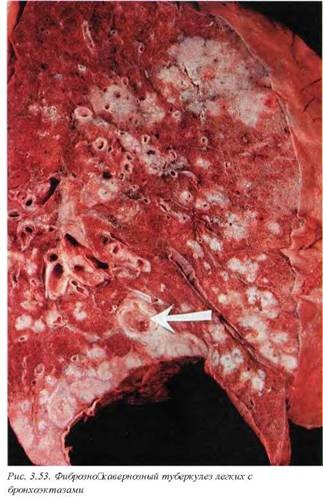
Характерно, что при активной форме болезни казеозный некроз быстро дает полостные изменения и диссеминацию инфекции (рис. 3.52, 3.53). Распространение туберкулезной инфекции осуществляется преимущественно через лимфатическую систему, или, как в случаях милиарного туберкулеза, гематогенно, с развитием туберкулезного процесса в других органах или в контралате ральном легком. У больных с иммуносупрессией распространение инфекционного процесса может происходить самыми разнообразными путями.
8.6.2. Микотические воспаления легких. Грибковые инфекции легких приобретают все большую роль в современной пульмонологии в связи с несколькими факторами. Это, во первых, применение антибиотиков широкого спектра действия и последующее развитие глубокого микоза как формы дисбактериоза, во-вторых, значительное увеличение числа больных с синдромом иммунодефицита. Некоторые патогены никогда не вызывают тяжелого заболевания у лиц с нормальным иммунитетом(например, крипткокк, кандида, пневмоцист). Другие эндемические микозы (гис- топлазмоз, кокцидиоидоз, паракокцидиоидоз) могут вызывать легкую форму заболевания у иммунокомпетентных лиц, однако становятся диссеминированными при иммунодефиците.
Гистоплазмоз (В39.9). Этиологическим фактором заболевания является грибковая инфекция Histoplasma capsulatum, которая является эндемической в некоторых районах мира, однако значительная часть случаев возникает спорадически в связи с миграцией населения. Клинически у лиц с нормальным уровнем иммунного ответа течение инфекции бессимптомное, хотя в некоторых случаях она приобретает форму хронической легочной патологии с развитием кавернозных повреждений паренхимы. В случаях им муносупрессии наблюдается гематогенная и, реже, лимфогенная диссеминация процесса с фульминантным течением.
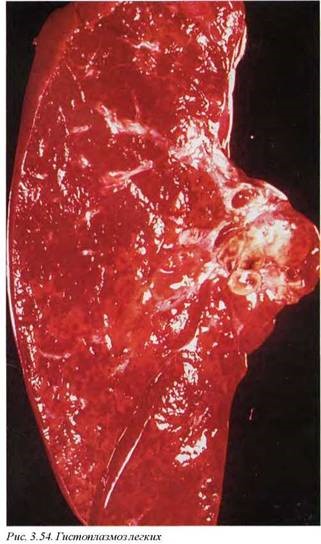
Макроскопически в легких или других органах определяются четко отграниченные плотные гранулемы округлой формы, в более крупных из них обнаруживаются краевая кальцификация и казеозное содержимое, которое по внешнему виду практически не отличается от казеоза при туберкулезе (рис. 3.54).
Кандидиаз (В37.1). Candida albicans является обычной флорой организма, но может проявляться как оппортунистическая инфекция. Наиболее частыми клинико-анатомическими синдромами являются кандидозный эзофагит и фунгемия, возникающая при катетеризации у госпитализированных больных с синдромом иммунодефицита. Диагноз системной болезни предполагает гистологическое подтверждение или вовлечение сетчатки. Инвазивный кандидиаз возникает при длительной нейтропении, в раннем послеоперационном периоде, при длительной терапии антибиотиками широкого спектра действия, внутривенной катетеризации особенно в случае тотального парентерального питания.
Кокцидиоидомикоз (В38) — микотическое, системное, преимущественно легочное заболевание. Этиологическим фактором является Coccidioides immitis, распространение которого в основном эндемическое, но может быть и спорадическим по причине миграции населения. Проявление патологии у иммунокомпе тентных лиц асимптоматическое или в виде быстропреходящей инфекции верхних дыхательных путей. При иммуносупрессии процесс диссеминированный и представляет собой острый генерализованный гранулематоз. Макроскопические изменения идентичны таковым при гистоплазмозе.
Аспергиллез (В44) — микотическое заболевание, в качестве этиологического фактора при котором выступает Aspergillus fumigatus. Выявлено более 350 различных штаммов организма, из которых 13 патогенны для человека. Аспергиллез может протекать в нескольких клинико-анатомических вариантах: аллергический бронхопульмональный аспергиллез, аспергиллома и инвазивный аспергиллез.
Аллергический бронхопульмональный аспергиллез возникает у больных с предшествующей астмой, что проявляется в тяжелом кашле, бронхоспазме с высокой эозинофилией, высоким уровнем IgE и специфическими преципитирующими антителами. В части случаев эта форма аспергиллеза осложняет течение муковисцидоза. Нелеченный аспергиллез приводит к возникновению диффузных и мешковидных бронхоэктазов с развитием цирроза легких.
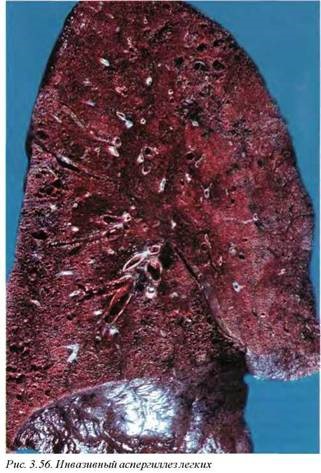
Аспергиллома (рис. 3.55) обычно возникает в области верхушки легкого и представляет собой опухолевидное образование различного размера, на разрезе представленное полостью, заполненной серовато-коричневыми сухими творожистыми массами, легко отделяемыми от внутренней поверхности капсулы. Содержимое представляет собой аккумуляцию мицетальных масс возбудителя. Плотная капсула активно вовлекает перифокальные ткани, в которых наблюдается значительный фиброз и деформация анатомических структур. Дифференциально -диагностическим признаком является свободное отделение содержимого от внутренней поверхности капсулы.
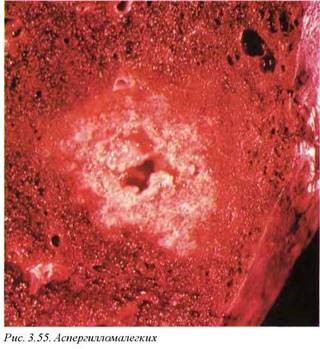
Инвазивный аспергиллез (рис. 3.56) может быть как первичным, возникающим в основном при иммунодефицитах любого происхождения (но преимущественно Т-клеточных), так и вторичным, развивающимся в исходе неинвазивных форм инфекции. Наиболее ярким примером является инвазивный аспергил- лез в исходе аллергического бронхопульмонального аспергиллеза у больных с астмой, длительно леченых стероидами. Больные с HIV-йнфекцией при СД4 менее 50 особенно чувствительны к этой форме инвазивной инфекции. Несмотря на выраженную диссеминацию, легочная патология является наиболее частой и развернутой.
Макроскопически выявляются множественные участки некротической пневмонии с диффузным геморрагическим синдромом, причем как в виде банальных кровоизлияний, так и классических инфарктов. Необходимо обратить внимание на зависимые зоны легких, поскольку инвазивный аспергиллез, поражая верхние дыхательные пути, может вызывать аспирацию крови. Необходимо помнить, что иммунологические реакции обладают низкой чувствительностью и специфичностью у этой категории больных, а кожная реакция на антиген может быть анергической.
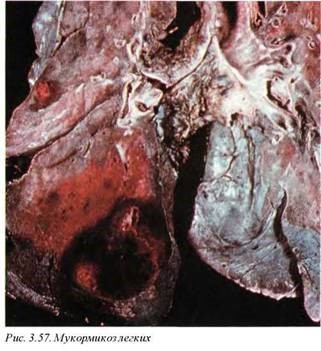
Мукормикоз (В46) (рис. 3.57). Этиологическим компонетом заболевания являются разнообразные плесневые грибы (родов Absidia, Mucor, Rhisopus). Болезнь чаще развивается на фоне диабетического кетоацидоза, хронической почечной недостаточности и длительной стероидной или другой иммуносупрессивной терапии. Для подтверждения инвазивного мукормикоза необходимо гистологическое исследование. Диссеминированная инфекция с инвазивным компонентом может наблюдаться в раннем периоде после начала агрессивной противораковой терапии.
Макроскопически определяются участки консолидации без формирования гранулем, в некоторых из фокусов обнаруживаются полости и эрозия сосудов с кровотечением. Полости могут быть заполнены кровью или дренироваться через бронхиальное дерево.
9. ПНЕВМОКОНИОЗЫ. Вдыхание загрязненного воздуха является неотъемлемой частью жизни городского населения. Тяжелые металлы, органические и неорганические пыли, химические компоненты — вот далеко не полный перечень веществ, вызывающих прямое повреждение легочной паренхимы. Различные минеральные и органические длительно вдыхаемые пыли вызывают специфические легочные реакции, наиболее многочисленная группа которых описывается как пневмокониозы.
Общим клинико-анатомическим симптомом для большинства ингаляционных болезней является хронический бронхит различной степени выраженности. В некоторых случаях обнаруживаются явления острой легочной недостаточности (массивные ингаляции в остром периоде), некардиогенного отека легких (прямое токсическое действие ирритантов) и астматических реакций (бронхоспазм).
Классические пневмокониозы связаны с хронической ингаляцией различных компонентов. Клинико-морфологические особенности каждой из нозологических единиц связаны с природой субстанции, концентрацией, размерами частиц и длительностью воздействия. Размеры частиц являются одним из наиболее важных критериев. Частицы размером около 3—5 мкм проникают в альвеолярные пространства и остаются внутри. Более мелкие частицы, находясь во взвешенном состоянии, покидают пространство альвеол вместе с выдыхаемым воздухом, а более крупные задерживаются в бронхах за счет слизистого барьера. Необходимо помнить, что 90% вдыхаемых частиц связываются и выделяются через бронхиальную слизь, а оставшиеся 10% являются тем самым повреждающим фактором.
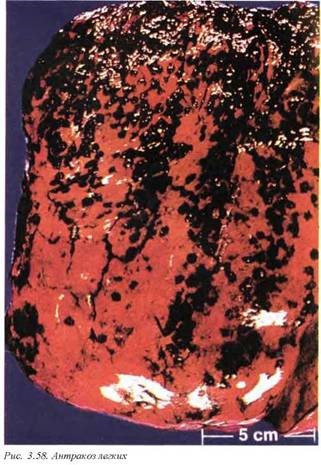
9.1. Антракоз (J60) (рис. 3.58). Аккумуляция угольной пыли определяется практически у каждого городского и многих сельских жителей. Черный пигмент депонируется в терминальных бронхиолах и в целом является безвредным. Однако у курильщиков дополнительные факторы повреждения легких приводят к развитию центролобулярной эмфиземы.
9.2. Силикоз (J62). Силикатная пыль является мощным легочным и бронхиальным ирритантом. Профессия выступает как наиболее значимый фактор риска: чаще всего силикозом болеют работники стекольной и металлургической промышленности, лица, занятые производством цемента, полировкой, работающие с песком, на строительстве.
Острое воздействие больших количеств силикатной пыли приводит к развитию экссудативного пневмонита. Болезнь связана с накоплением белковоподобных веществ в просвете альвеол, что ведет к дальнейшей организации патологического экссудата с развитием терминальной легочной недостаточности в пределах двух лет.
Хронический силикоз развивается в течение многих лет под воздействием силикатной пыли. В результате возникают силикатные узлы и распространенные фиброзные изменения в легких. В связи с персистенцией пыли в легких клинически болезньможет проявляться через большой промежуток времени после экспозиции. Патогенез силикоза связан со стимулированием фи бропластических и воспалительных процессов за счет фибробла стов и макрофагов.
В настоящее время последовательность фиброгенеза достаточно изучена и включает макрофагальный фагоцитоз с последующим разрушением наполненных макрофагов и повторным фагоцитозом, т.е. имеет место постоянно поддерживающийся процесс. Другая теория постулирует активацию фибробластного фактора роста с реализацией свободных радикалов, что вызывает дополнительные повреждения легочной паренхимы.
Клинически хронический силикоз развивается в течение долгого времени в виде постепенного снижения функции дыхания, одышки при нагрузках, а затем и в покое. Лица с хроническим силикозом имеют высокий риск заболеваемости туберкулезом легких (в ряде работ можно встретить термин «силикотуберкулез»), ревматоидным артритом (синдром Каплана), однако при данной патологии не наблюдается увеличения частоты злокачественных опухолей легких.
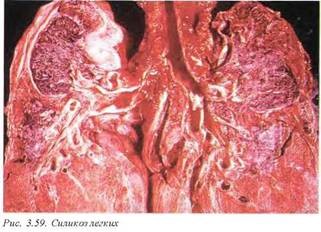
Макроскопически определяются множественные очень плотные милиарные и субмилиарные узлы в основном в верхних отделах легких, по периферии которых отмечается высокий дес мопластический эффект (рис. 3.59). Постепенно узлы увеличиваются, затем, особенно при запущенных формах, они сливаются в обширные образования. Наличие полостей, возникновение истинных гранулем и инфильтратов свидетельствуют о присоединившейся туберкулезной инфекции.
9.3. Пневмокониоз угольщика (J60). Эта патология присутствует в большей или меньшей степени у всех шахтеров, проработавших значительный период времени в забое (открытом или подземном). Различают простую форму (асимптоматическую) данного заболевания и прогрессирующий массивный фиброз, клинически аналогичный хроническому силикозу. Со временем простая форма болезни переходит в прогрессирующую. Этому способствуют следующие факторы: увеличение с годами общего количества воздействующей на легкие пыли, возникновение об литерирующего васкулита (дополнительные ишемические повреждения), сопутствующий силикоз в случае примеси двуокиси кремния в угольной пыли. Более сомнительным является присоединение туберкулеза с реактивацией (реинфекцией) и иммунологических механизмов, роль которых при этой форме пневмокониоза до конца не выяснена. Клинически при простой форме заболевания определяется сухой кашель, что может быть связано с эмфиземой легких. Прогрессирующий легочный фиброз характеризуется одышкой при нагрузках, затем в покое (по мере развития заболевания). Выраженное заболевание в классическом варианте представлено влажным кашлем с черной мокротой, не локализованной болью в грудной клетке и одышкой. Повышение температуры до субфебрильных цифр свидетельствует о присоединении туберкулеза.
Осложнения включают вторичную легочную гипертонию и декомпенсацию хронического легочного сердца. Некоторые случаи сопровождаются развитием синдрома Каплана (узлообразование в легких в сочетании с ревматоидным артритом).
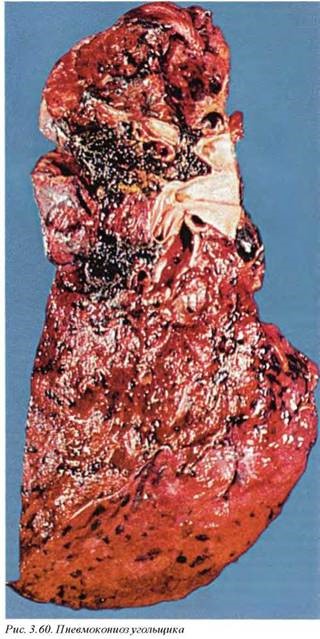
Макроскопически в начальных стадиях простая форма пнев мокониоза не отличается от антракоза, однако дифференцируется по интенсивности фиброза, который практически не наблюдается при угольной экспозиции в чистом варианте. Характерным является образование очаговых пигментированных фокусов до 1 см в диаметре (рис. 3.60). Эти очаги состоят из интактных пигментированных макрофагов вокруг бронхиол. По мере прогрессировав ния заболевания, по периферии и внутри очагов возникает интенсивный фибропластический процесс, и макулярные поражения трансформируются в нодулярные. Распространение фиброзных полей на сосуды приводит к развитию облитерирующего васкулита, вовлечение терминальных и респираторных бронхов — к центролобулярной эмфиземе.
Макроскопические изменения при прогрессирующем массивном фиброзе представлены диффузным утолщением плевры за счет обширных областей рубцевания черного цвета размером до 10 см. Наиболее измененными зонами являются нижние отделы верхних долей и верхние отделы нижних долей легких. Эти фиброзные очаги, впервые наблюдаемые при простой форме болезни, при прогрессирующем массивном фиброзе становятся сливными, что ведет к формированию черной дегенерации легких. В толще гранулем и рубцов распад не выявляется. Обнаружение распада в совокупности с кавернозными изменениями говорит о присоединившемся туберкулезе.
9.4. Асбестоз (J61). Среди профессиональных болезней одно из первых мест по заболеваемости и смертности занимает асбе- стоз. Высокий процент смертности от данного заболевания на сегодняшний день связан либо с собственно хронической легочной патологией, либо с возникновением злокачественных новообразований легких. В этиопатогенезе асбестоза обнаруживается ряд специфических характеристик. Так, интенсивность экспозиции не имеет пороговых значений, т.е. при более высоких дозах она является более значимым фактором риска, однако заболевание может возникнуть даже у членов семьи работника асбестовой промышленности, проживающих вместе с ним. Кроме того, повышенная вероятность заболевания имеется у жильцов строений старого типа.
Структурно различные волокна асбеста приводят к развитию либо хронической легочной патологии (хризотил или серпента - новые волокна), либо к высокому риску рака легкого (кросидо- тил или прямые волокна). Курение значительно увеличивает риск рака легкого после воздействия асбеста, но не влияет на частоту мезотелиомы. Клинически асбестоз протекает в виде неспецифического хронического интерстициального пневмонита.
Осложнения включают бронхоэктазы, легочное сердце и злокачественные опухоли легкого. При асбестовой экспозиции возникают несколько форм злокачественных опухолей, риск которых прямо коррелирует с ее интенсивностью:
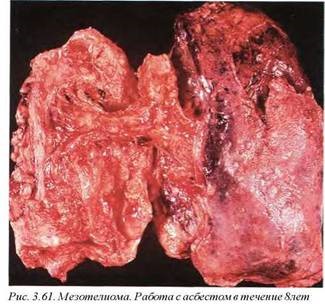
- мезотелиома (рис. 3.61). Частота этой асбестзависимой опухоли увеличивается приблизительно в 100-120 раз после экспозиции. Возможна как плевральная, так и перитонеальная форма заболевания. Опухоль возникает у 10-15% лиц с интенсивной экспозицией асбестовой пыли приблизительно через 20-40 лет после воздействия. Длительность выживания после установления диагноза составляет в среднем один год;
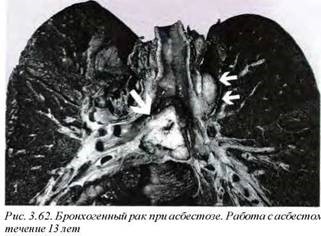
- бронхогенная карцинома (рис. 3.62) возникает в 4-5 раз чаще у лиц, подвергшихся воздействию асбеста, однако при сочетании асбестоза и курения частота бронхогенной карциномы вырастает в 60—90 раз по сравнению с некурящей популяцией;
- другие раки, частота которых увеличивается после воздействия асбеста, однако прямой коррелятивной связи с последним не обнаруживающие, включают рак желудка, рак толстого кишечника, почечно-клеточный рак и гастроинтестинальные лимфомы. В патогенезе рассматривается теория прямого канцерогенеза с активацией протоонкогенов и повышение активности фиброгенеза за счет активации фибробластов. Таким образом, механизмы возникновения и развития патологических процессов аналогичны таковым при силикозе.
Макроскопически при хроническом асбестозе определяется диффузный интерстициальный фиброз, симметрично расположенный: в нижних, долях обоих легких в сочетании с кальцифицированными и некальцифицированными плевральными бляшками. Плевра утолщена и интенсивно вовлечена в спаечный процесс.
9.5. Бериллиоз (J63.2). вызывается пылью или парами металлического бериллия и его соединений. Сплавы бериллия с магнием, медью, алюминием употребляются для изготовления особенно твердых, не искрящихся при трении деталей, поэтому бериллий широко применяется в приборостроении и авиационной технике, электронной и ядерной промышленности. Бериллиоз развивается у 2,5% лиц, подвергнувшихся воздействию бериллия, и протекает с различной интенсивностью, которая зависит от индивидуальных особенностей организма.
Острый бериллиоз. Обычно протекает как неспецифическая негранулематозная бронхопневмония или острый интерстициальный пневмонит. В исходе патологического процесса после однократной экспозиции возникает легочный фиброз с неспецифическим рисунком. В 10% случаев заболевание приобретает хроническую гранулематозную форму течения.
Хронический бериллиоз. Длительное воздействие бериллия приводит к развитию неказеозного хронического перибронхиального и периваскулярного гранулематозного воспаления. В основе формирования гранулем лежит IV тип реакции гиперчувствительности. Клинически наблюдаются прогрессирующая одышка, гранулематозный диффузный процесс (на рентгенограммах), прогрессирующая легочная недостаточность, которая и является непосредственной причиной смерти. Обычно течение болезни долгое, развитие терминальной недостаточности отмечается в среднем через 10—14 лет. Макроскопически определяются множественные мелкие плотные неказеозные гранулемы, в основном перибронхиальные, развившиеся на фоне диффузного пневмосклероза. Особенностью данного пневмокониоза является вовлечение в хронический гранулематозный процесс других органов (печень, почки, кожа и лимфоузлы).
10. ХРОНИЧЕСКИЕ ОБСТРУКТИВНЫЕ БОЛЕЗНИ ЛЕГКИХ. В течение многих лет клиницисты рассматривали хроническую эмфизему легких и хронический бронхит в рамках одного заболевания — хронического обструктивного заболевания легких. Оба этих патологических процесса клинически сходны и часто протекают совместно, особенно у курильщиков. Однако, с патологоанатомической точки зрения, это совершенно различные заболевания. Кроме того, ряд авторов относят к хроническим обструктивным заболеваниям легких бронхиальную астму, что является принципиально неверным, так как, во-первых, нарушение функции внешнего дыхания при астме связано не с хроническим, а с острым процессом, и, во-вторых, обструкция имеет спазматический генез в связи с гиперчувствительностью верхних дыхательных путей.
10.1 Эмфизема легких (J43). Патогенез хронической эмфиземы сложен и до конца не выяснен. Основой патологии является расширение ацинарных пространств в связи с деструкцией межальвеолярных перегородок. Причиной развития этого процесса является повышенная активность протеолитических ферментов, которые высвобождаются из лейкоцитов в ходе воспаления. Данная теория может быть подтверждена следующими положениями:
— эмфизема находится в тесной связи с загрязненным воздухом и курением. Оба эти фактора, непосредственно воздействующие на паренхиму легких, вызывают хроническое воспаление низкой интенсивности;
— при дефиците альфа1 антитрипсина □аутосомно -доминантном заболевании — теряется нормальная антипротеолитическая активность плазменных глобулинов. У больных с этой наследственной патологией обычно развивается ранняя и тяжелая эмфизема;
—табачный дым, в связи с высоким содержанием свободных радикалов, блокирует нормальную протеолитическую активность плазмы.
При эмфиземе легких деструкция межальвеолярных перегородок ведет к определенным клиническим феноменам. В связи с уменьшением эластичности легочной ткани возникает снижение потока воздуха при дыхании, что в свою очередь приводит к коллабированию дыхательной паренхимы на выдохе. Поверх
ность эффективного газообмена снижается. Эти патофизиологические механизмы приводят к прогрессирующей одышке и гипоксии со всеми соответствующими клиническими атрибутами. При далеко зашедших случаях эмфиземы развивается хроническая легочная гипертония, приводящая к легочному сердцу Основные морфологические субтипы хронической эмфиземы классифицируются в зависимости от локализации поражения.
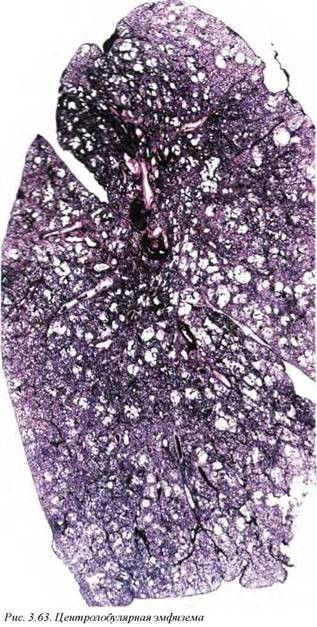
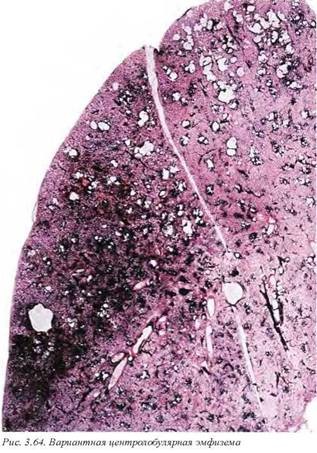
При центролобулярной эмфиземе (рис. 3.63, 3.64), которая является наиболее распространенным видом этого заболевания, поражаются респираторные бронхиолы, т.е. центральные ацинуП сы, оставляя альвеолы интактными. Центролобулярная эмфизема начинает развиваться в верхних долях, возникает чаще у мужчин и ассоциируется с курением.
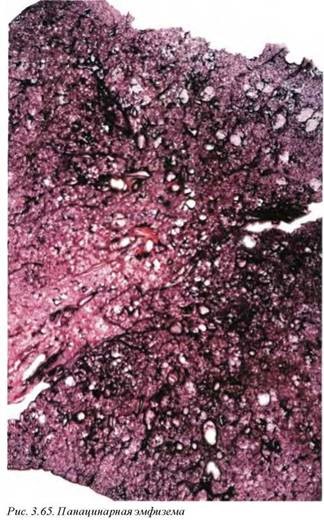
Панацинарная эмфизема (рис. 3.65) начинается в дистальных отделах ацинуса и в собственно альвеолярных перегородках и распространяется проксимально, вовлекая респираторные бронхиолы. Чаще наблюдается в нижних долях легких. Возникает при сколиозе, силикозе и синдроме Марфана, а также у лиц пожилого возраста. Этот тип эмфиземы в меньшей степени ассоциируется с курением, но чаще наблюдается при дефиците щ антитрипсина.
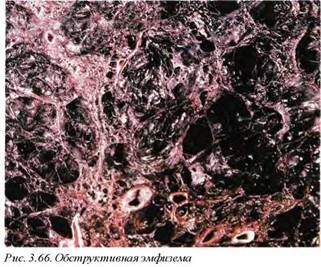
При обструктивной эмфиземе (рис. 3.66), возникающей в связи с дистальной обструкцией (хронический бронхиолит), происходит перерастяжение альвеол с разрывом альвеолярных перегородок.
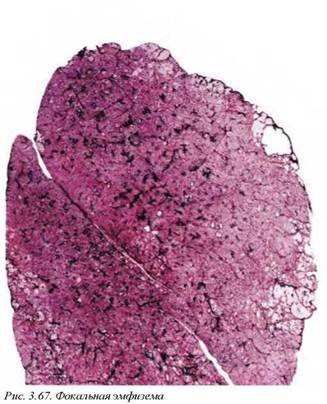
Для фокальной эмфиземы (рис. 3.67) характерно развитие значительных буллезных изменений и субплевральных кист обычно по периферии рубцов (заживший туберкулез или гистоплазмоз). Несмотря на достаточную распространенность данных явлений, этот процесс влияет на функцию дыхания в очень небольшой степени.
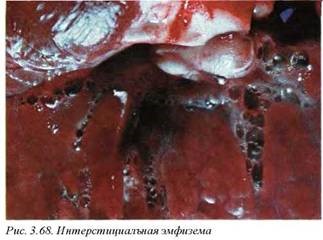
При старческой эмфиземе (хронической интерстициальной эмфиземе) (рис. 3.68) легкие значительно увеличиваются в объеме, плевральные пространства полностью заполнены легочной паренхимой, в связи с чем грудная клетка наредко принимает бочкообразную форму.
10.2. Хронический бронхит (J42). Несмотря на то что хронический бронхит рассматривается как обязательный компонент хронического обструктивного заболевания легких, в действительности истинной причиной нарушения функции дыхания является хронический бронхиолит. Однако хронический бронхиолит практически не встречается отдельно от хронического бронхита. Оба этих патологических процесса связаны с хроническим длительным раздражением дыхательных путей(курение, повышенная запыленность и загазованность).
Патогенез и патология хронического бронхита включает гиперсекрецию слизи, часто приводящую к хроническому продуктивному кашлю, что является типичным клиническим симптомом (бронхит курильщиков). На микроскопическом уровне патология хронического бронхита связана с метаплазией цилиндрического эпителия, подслизистым отеком, перибронхиальным и, в меньшей степени, интраальвеолярным пневмосклерозом. Патогенез хронического бронхиолита дополняется выраженным сужением дистальных бронхиол и значительным нарушением движения как вдыхаемого, так и выдыхаемого воздуха. В бронхиолярном эпителии преобладает метаплазия в бокаловидные клетки, что значительно увеличивает продукцию слизи. Потеря эластичности альвеолярных стенок, их перерастяжение и разрывы приводят к развитию эмфиземы.
11. ИНТЕРСТИЦИАЛЬНЫЕ БОЛЕЗНИ ЛЕГКИХ (J84). В литературе нередко можно встретить другие названия этой группы заболеваний — рестриктивные, или инфильтративные, болезни легких. В основе данных патологических изменений лежит значительное снижение эластичности легочной паренхимы (жесткое легкое), что всегда сопровождается нарушениями вентиляции и перфузии с различной степенью выраженности. Обычно значительно утолщенные интерстициальные пространства становятся малопроницаемыми для нормального обмена газов и диффузионная способность легких существенно снижается.
11.1.Диффузные альвеолярные повреждения (J80). При диффузных альвеолярных повреждениях легкие становятся тяжелыми и плотными в связи с развитием диффузного воспаления, отека и формированием гиалиновых мембран (внутриальвеолярных белковых депозитов). В ряде литературных источников настоящий процесс относят к синдрому шокового легкого, хотя это положение является сомнительным. В большинстве случаев присутствуют интерстициальный фиброз и воспаление.
Этиология этого патологического процесса весьма разнообразна и обычно включает множественные причины, имеющие как прямое, так и опосредованное действие на легочную паренхиму. Сюда относятся взрослый и детский типы дыхательного дистресс-синдрома, длительная искусственная вентиляция легких, токсическое действие кислорода, уремия, аспирационный синдром, легочные эмболии, ожоги верхних дыхательных путей, радиационный и вирусный пневмониты и др.
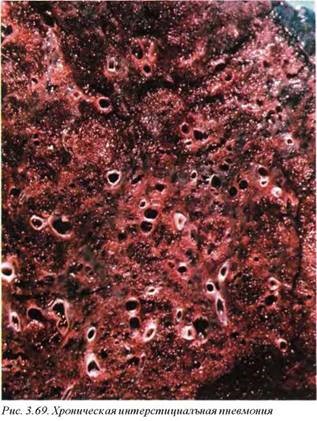
11.2. Хроническая интерстициальная пневмония (J84.9) (рис. 3.69). Этот патологический процесс зачастую лежит в исходе острой пневмонии, особенно мелкоочаговой бронхопневмонии. Основой его является интерстициальный инфильтрат, который развивается в течение многих лет и ведет к формированию легочного фиброза, а в конечном итоге — сотовидного легкого, имеющего весьма специфический макроскопический вид. Причинами развития сотовидного легкого являются пневмокониозы, хроническая пассивная венозная гиперемия, вдыхание нитратов, радиация, вирусная пневмония, аутоиммунные болезни соединительной ткани. Многие случаи хронической интерстициальной пневмонии являются идиопатическими.
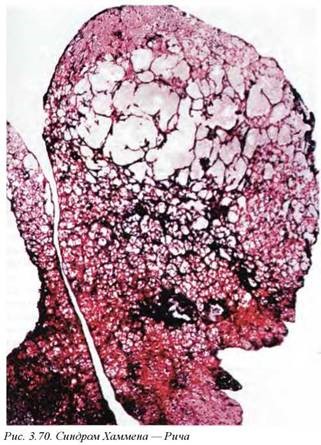
11.2.1. Классический интерстициальный пневмонит (фиброзирующий альвеолит, идиопатический легочный фиброз, синдром Хаммена — Рича) (рис. 3.70) — наиболее частый тип хронической интерстициальной пневмонии. Примерно в 50% случаев заболевание идиопатическое. Наиболее часто неидиопатические формы процесса ассоциируются с аутоиммунными болезнями соединительной ткани, особенно системным склерозом.
11.2.2. Десквамативный интерстициальный пневмонит характеризуется значительной пролиферацией и десквамацией альвеолярного эпителия, в основном пневмоцитов II типа — клеток, продуцирующих сурфактант
11.2.3.Лимфоидный интерстициальный пневмонит часто ассоциируется с синдромом Шегрена, ВИЧ и другими формами им мунодефицитов. Характеризуется интенсивной лимфоидной инфильтрацией межуточной ткани легких, иногда приобретающей более локальную форму, что следует дифференцировать с лимфомой и лейкемической инфильтрацией.
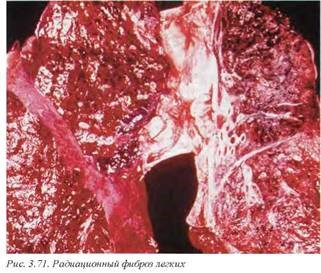
11.2.4. Радиационный фиброз легких (J70) (рис. 3.71). Диффузный неспецифический пневмосклероз, имеющий смешанную, бронхиально -сосудисто паренхиматозную локализацию. Макроскопически паренхима легких плотная, разрез сопровождается характреным скрипящим звуком. Обычно возникает в отдаленном периоде после радиационной терапии по поводу опухолей грудной полости. Более изолированные формы наблюдаются при радиационном лечении опухолей щитовидной железы (верхние доли легких) или процессов верхнего отдела брюшной полости (нижние доли легких).
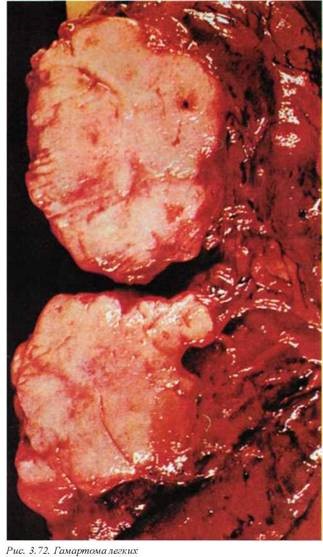
12.1. Доброкачественные опухоли легких встречаются довольно редко. Прежде всего к ним относятся гамартомы (D14), которые в легких можно рассматривать как зрелые тератомы (сочетание различных тканей). Макроскопически они представлены солидными или солиднокистозными опухолями до 4 см в диаметре, бело се

рого цвета, с множественными пестрыми красно-келтыми и коричневыми включениями (рис. 3.72). Остальные опухоли крайне редки и являются органонеспецифическими: липомы, фибромы, лейомиомы, невриномы. В любом случае вопрос о злокачественности легочной массы должен решаться только на основании гистологического исследования.
12.2. Злокачественные опухоли легких (С34). Подавляющее большинство опухолей легких (более 95%) являются злокачественными как по клинической картине течения, так и по морфологическим критериям. Принципиально злокачественные опухоли легких разделяются на две группы — первичные и метастатические.
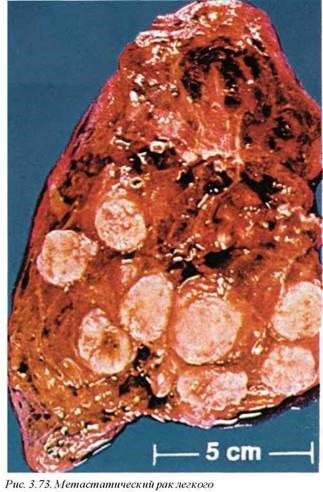
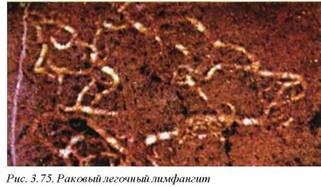
Метастатические опухоли (С78.0) составляют от 20 до 40% всех злокачественных опухолей и в 95% случаев имеют гематогенное или лимфогенное происхождение. Эпителиальные опухоли метастазируют преимущественно в легкие с развитием ракового лимфангита (рис. 3.73, 3.75). Нередко определяются и очаговые метастазы мезодермальных опухолей (см. рис. 3.74). Первичные опухоли обычно метастазируют путем эндобронхиальной диссе минации или при прямом прорастании в окружающие ткани.
95% первичных опухолей легких представлены бронхогенными карциномами, произрастающими из бронхиального эпителия в бронхах I и/или II порядка. Риск развития легочного рака в 20 раз выше у курильщиков. Бензпирен, содержащийся в табачных смолах, может инициировать развитие рака за счет как активации протоонкогенов (синтезируемых доминантными генами), так и депрессии регулирующих генов (рецессивных). Кроме того, табачный дым содержит и другие потенциальные канцерогены, такие как радиоактивные субстанции и тяжелые металлы. Более того, лица, проживающие в непосредственной близости к индустриальным зонам, также находятся в группе повышенного канцерогенного риска.
Высокая смертность от рака легкого ранее в основном отмечалась среди лиц мужского пола. В последнее время наблюдается неуклонный рост заболеваемости раком легкого у женщин (что связано с возрастанием частоты курения). На сегодняшний день, по данным многих авторов, рак легкого встречается у женщин так же часто, как и рак молочной железы, но, естественно, дает значительно более высокий процент смертности.
В клинико-анатомической картине этой группы злокачественных опухолей наряду с классическими конституциональным и легочным синдромами присутствуют гормональный и другие, более редкие синдромы: аутоиммунные болезни соединительной ткани, нейромиопатический синдром, патология коагуляции, кожный синдром и т.д. Все эти клинические проявления можно объединить под названием «паранеопластический синдром», хотя механизмы развития каждого из субтипов имеют отличия.
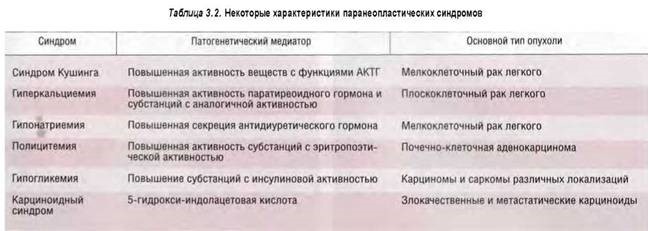
Кроме того, некоторые из названных клиникойнатомических феноменов наблюдаются при различных гистологических формах опухолей, тогда как другие имеют несомненную тропность к специфическим формам.
В табл.3.2 представлены некоторые характеристики паранеопластических синдромов.
Традиционно раки легкого делятся на две группы — мелко клеточные и немелкоклеточные. Это отражает не только особенности их гистологической структуры, но и клиническое течение, прогноз и принципы лечения.
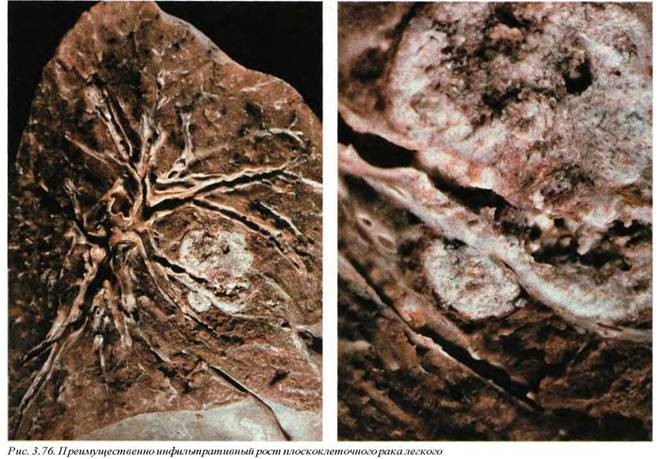
12.2.1. Плоскоклеточньй рак (М8070/ 3) составляет 32% в структуре злокачественных опухолей легких. Опухоль возникает из эпителия крупных (главных, долевых, сегментарных) бронхов. Опухоль больших размеров, расположена центрально, характеризуется явлениями как эндофитного (инфильтративного) (рис. 3.76), так и экзофитного (стенозирующего) роста (рис. 3.77), что находит выра
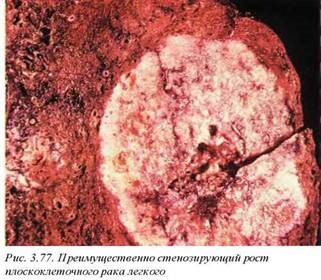
жение в различной клинической и морфологической симптоматике. Во многих случаях эти процессы сочетаются и тогда рост опухоли происходит по смешанному типу. Несколько чаще встречается у мужчин и коррелирует с курением. Клинические проявления опухоли зависят от локализации процесса, распространенности метастазов и наличия паранеопластических синдромов. Они включают неспецифические легочные проявления, конституциональный синдром, а также более специфические черты, связанные со стенозом соответствующего бронха, ателектазом и пневмонией. Плоскоклеточный рак метастазирует лимфогенно и гематогенно. Течение паранеопластического синдрома связано с выделением гормонально-активного вещества с функцией паратиреоидного гормона (ряд авторов считают, что это чистый паратгормон), что ведет к развитию гиперкальциемии.
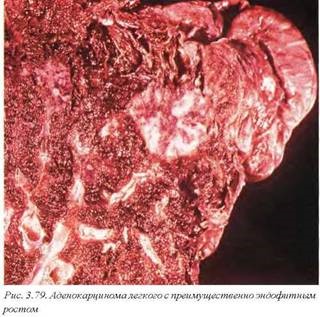
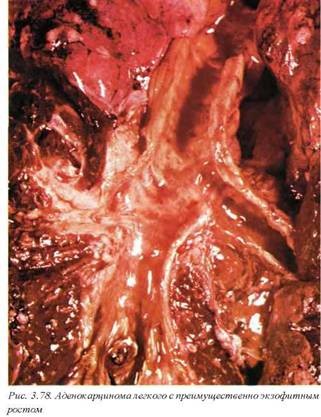
12.2.2. Аденокарцинома (М8140/3). Этот вариант рака в последнее время начал выходить на первое место среди злокачественных опухолей легких (около 38%). Аденокарцинома так же, как и плоскоклеточные раки, происходит из бронхов 1-го и 2-го порядка, однако обнаруживает тенденцию к периферическому росту. Встречается одинаково часто у лиц обоего пола и с курением непосредственно не ассоциируется. Традиционно считалось, что аденокарциномы развиваются чаще по периферии рубцовых изменений (например, постинфарктных), после травмы и т.д. В настоящее время это положение подвергается сомнению, поскольку установлено, что аденокарциномы обладают собственным достаточно высоким десмопластическим эффектом.
Макроскопически аденокарциномы представлены белыми плотными узлами, иногда с кровоизлияниями, формированием полостей распада или более гомогенными образованиями. Как и при плоскоклеточном раке, возможен как экзофитный, так и эндофитный рост опухоли (рис. 3.78,3.79). Одной из характерных локализаций аденокарциномы является периферическая часть легкого. В любом варианте макроскопическая симптоматика опухоли не является специфичной и диагноз, предполагающий соответствующее лечение и ведение больного, может быть поставлен только микроскопически.
Принято считать, что аденокарциномы растут медленнее, чем плоскоклеточные раки и имеют более благоприятный прогноз. Клинические проявления неспецифичны и включают легочный и конституциональный синдромы. Из паранеопластических синдромов наиболее характерными являются кардиоваскулярные: мигрирующий тромбофлебит и марантический неинфекционный эндокардит. У 30% больных на момент установления диагноза симптоматика отсутствует. Заболевание верхушечной и периферической локализации протекает с развитием синдрома Горнера (миоз, птоз, энофтальм и нефункционирующие потовые железы на стороне повреждения) либо синдрома Да Косты (нейроваскулярные осложнения при прорастании верхушечных раков).
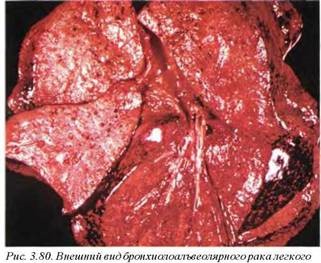
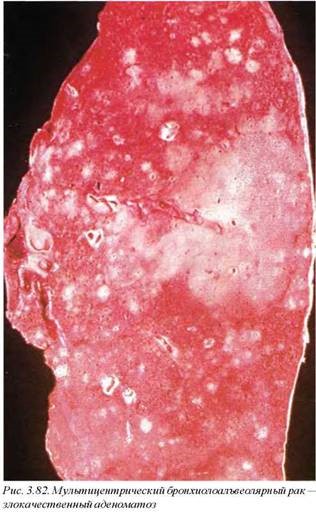
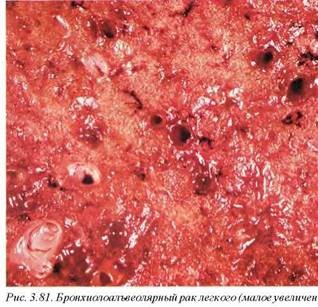
12.2.3. Бронхиолоальвеолярная карцинома (М8250/3). Данный тип опухоли является вариантом аденокарциномы. Развивается из бронхиального и бронхиолярного эпителия листальных отделов и клинически/рентгенологически не отличается от пневмонии. Макроскопически напоминает очаговую пневмонию с пестрым внешним видом. Опухоль солитарная или множественная (в этих случаях нельзя исключить как мультицентрический рост, так и внутрилегочное метастазирование) (рис. 3.80, 3.81). Узлы с выраженным инфильтративным ростом и неопределяемыми контурами. В большинстве случаев макроскопическая картина напоминает организующуюся бронхопневмонию. Ряд авторов рассматривают двустороннее поражение легких при бронхиолоальвеолярной карциноме как аденоматоз (М8140/3) (рис. 3.82). Эти опухоли составляют около 1—3% раков легкого.
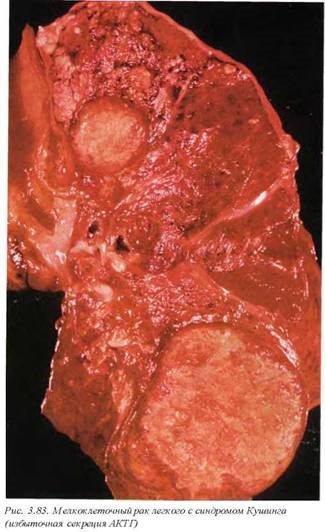
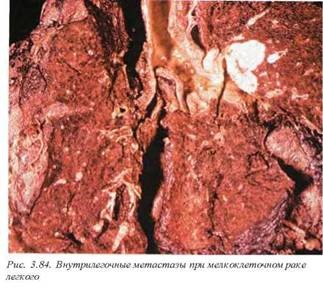
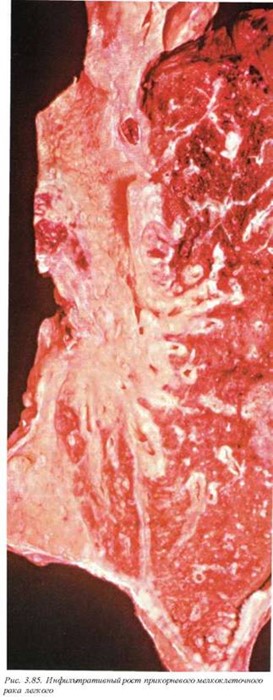
12.2.4. Мелкоклеточный рак (М8041/3—М8045/3). Эта группа опухолей составляет около 30% раков легкого и имеет некоторые характерные черты, позволяющие в ряде случаев дифференцировать их с немелкоклеточными формами. Во-первых, 40% больных на момент установления диагноза выявляют разнообразные по своей клинической картине паранеопластические синдромы (рис. 3.83). Поскольку мелкоклеточные раки происходят из нейП роэндокринного бронхиального эпителия, патофизиологической основой паранеопластических синдромов является синтез разнообразных нейрогуморальных продуктов. Для мелкоклеточных опухолей достаточно показательными являются синдром Кушинга (избыточная секреция АКТГ), избыточная секреция антидиуретического гормона (состояние, противоположное несахарному диабету), нейромышечная патология. Последняя группа включает миастеноподобный синдром (синдром Ламберта—Итона, связанный с нарушением секреции ацетилхолина), подострую церебеллярную дегенерацию и сенсорную (сенсомоторную) нейропатию. Такие паранеопластические синдромы как кожные, гематологические или дерматомиозит, в одинаковой степени встречаются при всех видах опухолей. Во-вторых, на момент первичного установления диагноза 55-65% больных имеют вну трилегочные или регионарные метастазы либо массивную инфильтрацию легочной паренхимы (рис. 3.84, 3.85). Макроскопически отличия мелкоклеточного рака от других очаговых форм не определяются либо они столь незначительны, что не могут быть использованы в качестве морфологических критериев диагностики.
12.2.5. Другие злокачественные опухоли легких.
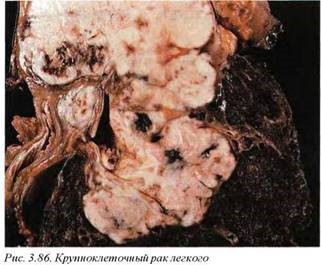
Крупноклеточный раклегкого (М8012/3) (рис. 3.86) относится к группе недифференцированных новообразований, иногда рассматривается как нейроэндокринная опухоль. Клинически может протекать с преимущественными паранеопластическими синдромами, из которых наиболее характерным является развитие гипертрофической легочной остеохондропатии. Макроскопически не отличается от других раков центральной локализации.
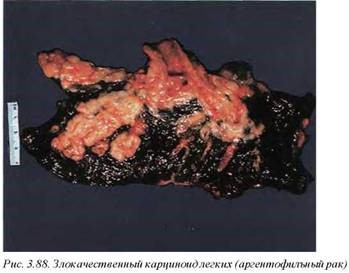
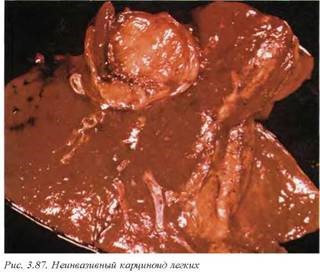
Карнитюидные опухоли ( М8241/3) (рис. 3.87, 3.88). В недалеком прошлом существовала неверная трактовка гисто и морфогенеза этой группы опухолей, и их относили к бронхиальным аденомам. Карциноиды располагаются в крупных бронхах, растут эндобронхиально с развитием ателектаза, иногда обнаруживают инфильтративный рост. Могут давать гематогенные и реже лимфогенные метастазы. Относятся к патологии APUD -системы и секретируют разнообразные биогенные амины. Однако в клинической картине данных заболеваний карциноидный синдром встречается редко — в случае, если опухоль представлена только легочной локализацией. Прогноз опухолей благоприятный, более 85% лиц выживают в течение пяти и более лет. Макроскопически опухоли эндобронхиальные, иногда на широком основании в виде полипов, серо-белые, плотные, на поверхности разреза мелкозернистые, часто с хорошо выраженной капсулой.
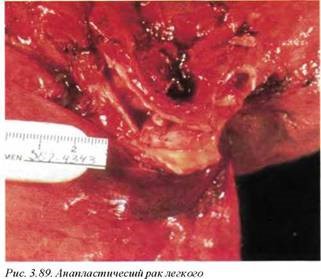
Анапластический рак легкого (М8021/3) (рис. 3.89) составляет менее 1% всех раков данного органа. В случае когда опухоль невозможно классифицировать как идентифицируемую форму, диагноз устанавливается на основании гистологического исследования. Опухоль не имеет преимущественной локализации, однако чаще она бывает представлена центральным узлом с распространенными некрозами и образованием полостей. Опухоль метаста- зирует рано, преимущественно лимфогенно.
13. ДРУГИЕ ЗАБОЛЕВАНИЯ И ПАТОЛОГИЧЕСКИЕ СОСТОЯНИЯ СИСТЕМЫ ОРГАНОВ ДЫХАНИЯ.
13.1. Легочный протеиноз ( J84.0) является хроническим легочным заболеванием неясной этиологии. Клинически характеризуется прогрессирующей одышкой, продуктивным кашлем с выделением густой желтой мокроты, болями в грудной клетке, конституциональным синдромом. Морфологической основой заболевания является накопление липопротеидов в альвеолярных пространствах. Достаточно часто при настоящем заболевании определяется нокардиозная инфекция (Nocardia asteroides или N ocardia brasiliensis). Аэробные филаментозные бактерии являются этиологическим фактором легочной или системной инфекции. При легочном диспротеинозе возможны как колонизация, так и собственно инфекция. Инфекция выявляется значительно чаще при иммуносупрессии. В запущенных случаях локальный инфекционный процесс (абсцесс легких) может распространяться на грудную стенку и вовлекать ребра с формированием остеомиелита. Диссеминация может вовлекать любой орган, но чаще всего головной мозг и кожу.
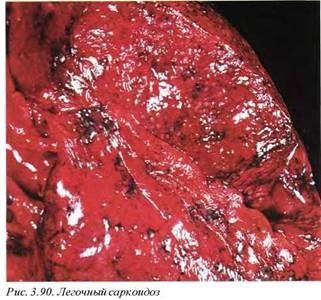
13.2. Легочный саркоидоз (D86.0) — мультисистемное хроническое гранулематозное заболевание неясной природы. В большинстве случаев патологический процесс развивается в легких и характеризуется формированием множественных неказеозных гранулем без специфической локализации (рис. 3.90). Аналогичные патологические изменения определяются в прикорневых лимфоузлах и плевре.
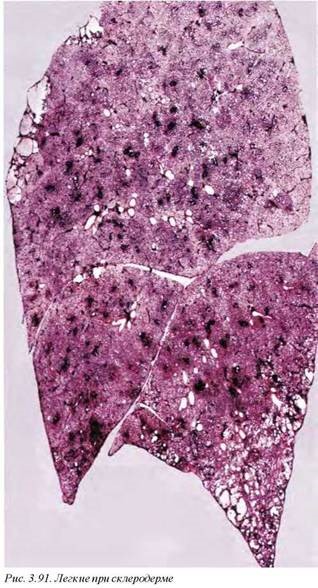
13.3. Поражения легких при системных заболеваниях соединительной ткани. При системных заболеваниях соединительной ткани вовлечение в патологический процесс легких является достаточно частой находкой, однако их морфологическая картина неспецифична. Наиболее распространенной макроскопической формой поражения легких при системных аутоиммунных болезнях соединительной ткани является развитие неспецифического легочного фиброза (рис. 3.91, 3.92). В некоторых случаях можно обнаружить формирование межуточных гранулем милиарных и субмилиарных размеров (не превышающих 1 мм).