C.В. Яковлев, Московская медицинская академия им. И.М.Сеченова
Введение
Острые инфекции верхних дыхательных путей являются самыми частыми заболеваниями в амбулаторной практике, с которыми встречаются не только отоларингологи, но терапевты и педиатры. В большинстве случаев при этих инфекциях врачи назначают системные антибиотики. В медицинской практике на долю острых респираторных инфекций приходится около 75% назначений системных антибиотиков [1, 2]. При этом не все острые инфекции верхних дыхательных путей имеют бактериальную этиологию. Часть инфекций вызываются вирусами, на которые системные антибиотики не действуют. По данным различных фармакоэпидемиологических исследований, в 20-50% случаев острых респираторных инфекций назначение системных антибиотиков признано неоправданным [2-4].
Переоценка практическими врачами эффекта системных антибиотиков при острых инфекциях верхних дыхательных путей объясняется высокой частотой спонтанного выздоровления пациентов при этих инфекциях и ошибочным мнением, что системные антибиотики предотвращают развитие бактериальной суперинфекции при вирусных заболеваниях [2, 3, 5].
Степень неадекватности назначения системных антибиотиков при острых респираторных инфекциях различна. Назначение системных антибиотиков при простуде или острых респираторных вирусных инфекциях (ОРВИ), остром ларингите, трахеите, бронхите и рините почти всегда не оправдано, так как в большинстве случаев это - вирусные инфекции. В то же время назначение системных антибиотиков при остром синусите и фарингите в ряде случаев оправдано, однако должно быть веско обосновано.
Можно выделить потенциальную пользу и вред назначения системных антибиотиков при острых инфекциях верхних дыхательных путей, характеризующихся высоким уровнем спонтанного выздоровления (табл. 1).
Таблица 1.Последствия назначения антибиотиков
- Предотвращение осложнений заболевания
- Потенциальная эффективность у ряда пациентов
- Более быстрые исчезновения симптомов и выздоровление
- Аллергические реакции, в том числе тяжелые и жизнеопасные
- Побочные эффекты
- Дополнительная стоимость лечения
- Селекция и распространение резистентных штаммов бактерий в популяции
В плацебо-контролируемых исследованиях у взрослых пациентов и детей с острыми инфекциями верхних дыхательных путей существенных преимуществ системных антибиотиков, как в частоте выздоровления, так и в сроках исчезновения симптомов заболевания, выявлено не было [2, 6-8]. Доказано, что системные антибиотики при вирусных инфекциях верхних дыхательных путей не предотвращают бактериальные осложнения, такие как пневмония или острый средний отит. Некоторые серьезные осложнения острого риносинусита, такие как менингит и абсцесс мозга, очень редки, и в настоящее время отсутствуют данные, подтверждающие эффективность системных антибиотиков в профилактике развития этих осложнений [7, 9].
Если польза от применения системных антибиотиков при многих острых респираторных инфекциях кажется сомнительной, то потенциальный вред неоправданной системной антибиотикотерапии сложно переоценить. Побочные эффекты на фоне применения системных антибиотиков наблюдаются нередко, особенно со стороны желудка и кишечника. Некоторые побочные эффекты потенциально жизнеопасны - в частности, удлинение интервала QT, наблюдающееся при применении макролидов и некоторых фторхинолонов.
Аллергические реакции при применении пенициллинов имеют место примерно в 5%. Некоторые аллергические реакции наблюдаются редко, но потенциально фатальны - например, синдром Стивенса-Джонсона на фоне применения ко-тримоксазола. Наконец, избыточное применение системных антибиотиков способствует возникновению и распространению в популяции резистентных штаммов микроорганизма, в частности наиболее значимых респираторных патогенов - Streptococcus pneumoniae и Streptococcus pyogenes [2, 10, 11].
Этиология и патофизиология
Возбудителями острых инфекций верхних дыхательных путей могут быть вирусы и бактерии, среди последних доминируют Streptococcus pneumoniae, Haemophilus influenzae, Streptococcus pyogenes. Этиологическая структура заболеваний может различаться в зависимости от локализации инфекции (табл. 2).
Таблица 2.Этиологическая структура инфекций верхних дыхательных путей
Примечание. Микроорганизмы в каждом ряду указаны в порядке уменьшения значимости.
Однако даже в случаях "банальной" простуды чисто вирусная этиология может только предполагаться. Известно, что слизистая оболочка ротоглотки не является стерильной средой и, даже в норме, заселена бактериями. У пациентов с хроническими заболеваниями ЛОР-органов, у часто болеющих детей возможны дисбиотические нарушения, при которых на слизистой оболочке постоянно персистирует и патогенная микрофлора. В какой момент патологического процесса при ОРВИ происходит активация патогенной бактериальной флоры и основным этиологическим фактором становятся не просто вирусы, а вирусно-бактериальные ассоциации, определить практически невозможно. В любом случае такая вероятность существует.
Этапы развития бактериальной респираторной инфекции заключаются в адгезии микробов к клеткам респираторного эпителия с помощью специфических бактериальных структур - адгезинов (у S. pyogenes эту функцию выполняет комплекс липотейхоевых кислот и М-протеина) в результате чего возникает микробная колонизация эпителия.
Важнейшим свойством респираторных патогенов является способность к активной инвазии клеток эпителия, что происходит при нарушении барьерных функций в результате неспецифического воспаления, ишемии, вирусных поражений респираторного тракта. Бактериальная инвазия сопровождается активацией клеточных и гуморальных неспецифических факторов противоинфекционной резистентности, в результате чего развивается воспалительная реакция слизистых дыхательных путей (отек, гиперемия, повышенная секреция), которая и обусловливает появление характерной симптоматики.
Таким образом, воспаление имеет важное значение в клинической картине острых инфекций верхних дыхательных путей.
Резистентность
В последние 10 лет все более актуальной проблемой становится резистентность респираторных патогенов. Наиболее значимой является резистентность S. pneumoniae к пенициллину, макролидам, ко-тримоксазолу, S. pyogenes - к макролидам, тетрациклину. Резистентность S. pneumoniae к пенициллину и макролидам в некоторых странах Европы достигает 40-50%, резистентность S. pyogenes к макролидам составляет 30-40%, что ограничивает возможности эффективной терапии инфекций верхних дыхательных путей.
В частности, показано снижение клинической и бактериологической эффективности макролидов при респираторных инфекциях, вызванных резистентными штаммами S.pneumoniae или S.pyogenes [12-14]. Уровень резистентности (высокой и умеренной) S.pneumoniae к пенициллину в России составляет около 20%, сходный уровень резистентности (в пределах 20%) отмечается среди S.pyogenes к макролидным антибиотикам [15].
Наиболее важным фактором, способствующим возникновению и селекции резистентности в популяции, является широкое, часто неоправданное, использование системных антибиотиков.
Так, в некоторых фармакоэпидемиологических исследованиях была показана прямая зависимость между предшествующим применением b-лактамных антибиотиков и частотой колонизации верхних дыхательных путей пенициллин-резистентными штаммами S.pneumoniae [10, 11, 16]. Сходные данные приводятся о прямой зависимости между частотой использования макролидов и носительством пневмококков, резистентных к макролидам и пенициллину [17]. Следует также учитывать, что системные антибиотики способствуют селекции резистентных штаммов нормальной микрофлоры полости рта, кожи и кишечника.
В частности, установлено, что стрептококки группы Viridans являются "резервуаром" резистентности к эритромицину и другим антибиотикам и способны передавать факторы резистентности другим микроорганизмам - S.pneumoniae и S.pyogenes [18].
В то же время ограничительная политика использования системных антибиотиков способствует уменьшению частоты антибиотико-резистентных штаммов респираторных патогенов. В Японии в 1970-80-х гг. наблюдали выраженное снижение частоты резистентных к эритромицину штаммов S. pyogenes с 61,8 до 1-3% после сокращения потребления макролидов со 170 до 65-85 т. ежегодно [19]. В Финляндии снижение частоты использования макролидов на 50% привело к снижению резистентности S. pyogenes к эритромицину в 2 раза [20].
Когда показаны системные антибиотики
Учитывая глобальную угрозу распространения антибиотико-резистентных штаммов респираторных патогенов в обществе и прямую связь этого явления с чрезмерным использованием этих лекарственных препаратов, ряд неправительственных организаций - Центр по контролю заболеваний (США; CDC), Альянс за разумное использование антибиотиков (APUA), Всемирная организация здравоохранения (ВОЗ) - сформулировали стратегию ограничительной политики применения системных антибиотиков при амбулаторных респираторных инфекциях как реальную меру сдерживания резистентности.
Основная цель данной концепции заключается в ограничении неоправданного назначения системных антибиотиков при острых инфекциях верхних дыхательных путей. Материалы по рациональному применению антибиотиков представлены в документах "Principles of Judicious Use of Antimicrobial Agents for Pediatric Upper Respiratory Tract Infections" (CDC, 1998) [21] и "Principles of Appropriate Antibiotic Use for Treatment of Acute Respiratory Tract Infections in Adults" (2001) [5, 22, 23].
Основные положения первого документа сформулированы ниже.
- Системные антибиотики не следует назначать при вирусных инфекциях, таких как простуда и ОРВИ. Применение системных антибиотиков при вирусном риносинусите не предотвращает бактериальные осложнения.
- Простуда часто сопровождается ринитом со слизисто-гнойным отделяемым. Это не является показанием для назначения системных антибиотиков, если симптоматика не сохраняется более 10-14 дней.
- Неспецифический кашель и бронхит у детей независимо от длительности не требуют системной антибактериальной терапии.
Наиболее важные положения второго документа.
Острая неспецифическая инфекция верхних дыхательных путей у взрослых:
- данные инфекции имеют преимущественно вирусную этиологию, и при них осложнения наблюдаются редко. Системные антибиотики не следует назначать для лечения неспецифических инфекций верхних дыхательных путей у ранее здоровых взрослых.
Острый синусит у взрослых:
- острый бактериальный синусит не требует системной антибактериальной терапии, особенно если симптоматика легкая или умеренная;
- системная антибиотикотерапия показана больным острым синуситом с выраженной или длительно сохраняющейся симптоматикой. В этом случае на первом этапе предпочтительно использовать системные антибиотики узкого спектра.
Острый фарингит у взрослых:
- все пациенты с острым фарингитом должны получать в адекватных дозах анальгетики, антипиретики и другие симптоматические средства;
- системные антибиотики показаны только в случае высокой вероятности стрептококковой этиологии фарингита (бета-гемолитический стрептококк группы А - БГСА);
- экспресс-диагностика с помощью исследования антигена БГСА желательна при подозрении на стрептококковую этиологию фарингита.
Антибиотикотерапия
В тех случаях, когда имеется высокая вероятность вирусно-бактериальной этиологии инфекций верхних дыхательных путей или высокий риск осложнений, показано применение антибиотиков.
Системная антибиотикотерапия при инфекциях верхних дыхательных путей показана, в основном, только в следующих случаях:
- острый синусит среднетяжелого/тяжелого течения или синусит с длительно сохраняющейся симптоматикой;
- острый тонзиллофарингит предполагаемой или установленной стрептококковой этиологии (возбудитель - бета-гемолитический стрептококк группы А-БСГА).
При выборе системного антибиотика следует учитывать современные тенденции антибиотикорезистентности и тот факт, что некоторые антибиотики способствуют селекции в популяции резистентных штаммов респираторных патогенов. В этой связи при нетяжелом течении заболевания предпочтительны антибиотики узкого спектра (например, амоксициллин), активные в отношении основных целевых патогенов - S. pneumoniae, S. pyogenes, H. influenzae. Антибактериальные препараты с более широким спектром, такие как амоксициллин/клавуланат, цефалоспорины II-III поколений, респираторные фторхинолоны, следует резервировать для более тяжелых случаев или высокой вероятности устойчивых микроорганизмов.
Учитывая современные рекомендации по ограничению назначения системных антибиотиков при острых неосложненных инфекциях верхних дыхательных путей, реальной альтернативой является применение местных антимикробных средств. Среди местных антибиотиков следует выделить фузафунгин, фрамицетин и биклотимол.
Наиболее важными свойствами фузафунгина является активность в отношении практически всех респираторных патогенов (стрептококков, пневмококков, стафилококков, микоплазмы, гемофильной палочки) и наличие местного противовоспалительного действия. На фоне применения фузафунгина не отмечено селекции штаммов, устойчивых к нему или другим антибиотикам. Местное применение фузафунгина при острых инфекциях верхних дыхательных путей отвечает современным рекомендациям по сдерживанию антибиотикорезистентности в популяции, так как в результате целенаправленной доставки антибиотика к очагу инфекции отсутствует системное воздействие и имеется меньший риск селекции резистентных штаммов нормальной микрофлоры.
По уровню антимикробной активности против основных возбудителей острых респираторных инфекций фрамицетин и комбинированные препараты, содержащие неомицин и полимиксин, уступают фузафунгину.
Следует отметить, что широко распространенная в некоторых медицинских учреждениях практика введения в околоносовые пазухи растворов системных антибиотиков, предназначенных для парентерального применения, не может быть признана рациональной. Эти препараты не предназначены для полостного введения. При их местном применении создаются неравномерные концентрации в разных участках околоносовых пазух, что может способствовать селекции резистентных штаммов. Кроме того, режим дозирования системных антибиотиков при местном применении не изучен и следует помнить о возможном неблагоприятном воздействии больших доз антибиотиков на функцию мерцательного эпителия.
Этих недостатков лишены антибиотики, специально разработанные для местного применения, в частности фузафунгин. Эффективность фузафунгина при острых респираторных инфекциях (ринофарингит, риносинусит) подтверждена в 4-х двойных слепых плацебо-контролируемых исследованиях [24-25]. Показано, что фузафунгин при местном применении приводит к достоверно более быстрому, чем плацебо, исчезновению симптомов инфекции. Кроме того, при назначении фузафунгина на ранних стадиях острых респираторных инфекций достоверно снижается частота назначения практикующими врачами системных антибиотиков, а также уменьшается потребность в анальгетиках и местных глюкокортикоидах [26].
Таким образом, при острых нетяжелых бактериальных инфекциях верхних дыхательных путей возможно излечение пациентов при назначении фузафунгина без добавления системных антибиотиков. Данное утверждение подтверждено в проведенном нами сравнительном исследовании.
Оценка клинической и бактериологической эффективности фузафунгина при острых инфекциях верхних дыхательных путей
Нами проведено открытое рандомизированное исследование по изучению сравнительной эффективности фузафунгина (Биопарокса) при острых респираторных инфекциях в режиме монотерапии и в комбинации с макролидным антибиотиком кларитромицином.
Задачами исследования являлись:
- изучение сравнительной эффективности фузафунгина в режиме монотерапии и в комбинации с кларитромицином;
- оценка быстроты исчезновения симптомов заболевания и переносимости сравнимаемых режимов терапии;
- изучение бактериологической эффективности фузафунгина и риска селекции резистентных штаммов микроорганизмов в процессе терапии.
В исследование включались пациенты старше 18 лет с документированным диагнозом острой инфекции дыхательных путей нетяжелого течения:
- острый фарингит/тонзиллит;
- острый риносинусит;
- острый трахеобронхит.
В исследование не включались пациенты с хроническими или аллергическими заболеваниями дыхательных путей, а также с инфекцией, вызванной S. pyogenes.
Фузафунгин назначали в виде ингаляций (по 4 дозированные ингаляции в каждый носовой ход и 4 ингаляции через рот для орошения задней стенки глотки и миндалин) 4 раза в день. Кларитромицин назначали внутрь в дозе 500 мг 2 раза в сутки.
Рандомизация пациентов в одну из групп лечения осуществляли методом конвертов (рис. 1).
Оценка клинических симптомов проводилась до лечения и ежедневно во время лечения. Оценивали наличие и выраженность симптомов (головная боль, заложенность носа, количество отделяемого из носа, чихание, отечность миндалин, гиперемия задней стенки глотки) по качественной балльной шкале:
- 0 - симптом отсутствует;
- 1 - симптом слабо выражен;
- 2 - симптом выражен умеренно;
- 3 - симптом сильно выражен.
Динамику других симптомов оценивали с помощью количественной шкалы.
Характер отделяемого из носа и характер мокроты:
- 0 - отделяемого нет;
- 1 - слизистый характер;
- 2 - слизисто-гнойный характер;
- 3 - гнойный характер.
- 0 - мокроты нет;
- 1 - до 10 мл/сут;
- 2 - 10-50 мл/сут;
- 3 - более 50 мл/сут.
Потребность в деконгестантах и анальгетиках:
- 0 - не используются;
- 1 - 1 раз в сутки;
- 2 - 2-3 раза в сутки;
- 3 - более 3 раз в сутки.
У всех пациентов до и после лечения брали мазок из носа или зева для бактериологического исследования. Определяли чувствительность выделенных микроорганизмов к антибактериальным препаратам дискодиффузионным методом.
Оценку эффективности лечения проводили на 7-й день терапии и через 10-14 дней после окончания лечения.
Результаты исследования
В исследование были включены 60 пациентов с острой инфекцией верхних дыхательных путей. Итоговая оценка эффективности лечения проведена у 51 пациента, из них 26 пациентов (1-я группа) получали фузафунгин, 25 пациентов (2-я группа) - фузафунгин и кларитромицин. Девять пациентов выбыли из исследования, так как не пришли на последующие визиты.
Характеристика пациентов, закончивших исследования, представлена в табл. 3.
Таблица 3.Характеристика пациентов
На фоне лечения у большинства пациентов был достигнут быстрый и отчетливый клинический эффект. Результаты оценки клинической эффективности на 7-й день лечения и через 10-14 дней по окончании лечения представлены в табл. 4.
Таблица 4.Клиническая и бактериологическая эффективность и переносимость сравниваемых режимов терапии острых респираторных инфекций
Группа 1 (фузафунгин) n=26
Группа 2 (фузафунгин + кларитромицин) n=25
Клиническая оценка на 7-й день лечения, %
Бактериологическая оценка на 7-й день лечения*
Клиническая оценка через 10-14 дней после лечения
вероятно, связанных с лечением
Примечание. *Оценка проведена у 14 и 16 пациентов 1-й и 2-й групп, у которых до лечения были выявлены клинически значимые микроорганизмы.
Клинические результаты лечения не различались у больных 1-й и 2-й групп как при оценке в конце терапии (84,6 и 76%), так и через 10-14 дней по окончании терапии (96,2 и 96%). Небольшие различия, отмеченные в конце лечения в пользу пациентов 1-й группы, не были достоверны.
Клинический эффект отсутствовал у одного пациента 2-й группы с диагнозом "острый трахеобронхит", что потребовало назначения амоксициллина. У одного пациента 1-й группы, получавшего фузафунгин по поводу острого риносинусита, отмечен положительный клинический эффект в конце лечения, однако через неделю наблюдался рецидив инфекции. При первичном исследовании мазка из носа у него выявлен стрептококк группы А, который персистировал к концу лечения и выделен также во время рецидива инфекции.
Бактериологическая эффективность двух режимов терапии также была одинаковой, небольшие различия в уровне эрадикации возбудителей в пользу пациентов 2-й группы (64,3 и 75%) были недостоверны. У пациентов 1-й группы на фоне лечения фузафунгином наблюдалась эрадикация 3 из 3 штаммов S. pneumoniae, 2 из 4 штаммов S. aureus, 1 из 2 штаммов S. pyogenes и 1/1 штамма H. influenzae. В случае персистирования микроорганизмов ни в одном случае не наблюдалось формирования устойчивости к пенициллинам или макролидам. У пациентов 2-й группы достигнута эрадикация 5 из 7 штаммов S. pneumoniae, штамма S. aureus и 3 штаммов грамотрицательных бактерий.
Нами проанализирована динамика исчезновения симптомов при различных инфекциях: остром тонзиллите/фарингите (рис. 2), остром риносинусите (рис. 3), остром трахеобронхите (рис. 4).
Рис. 2.Динамика исчезновения симптомов острого тонзиллита/фарингита.
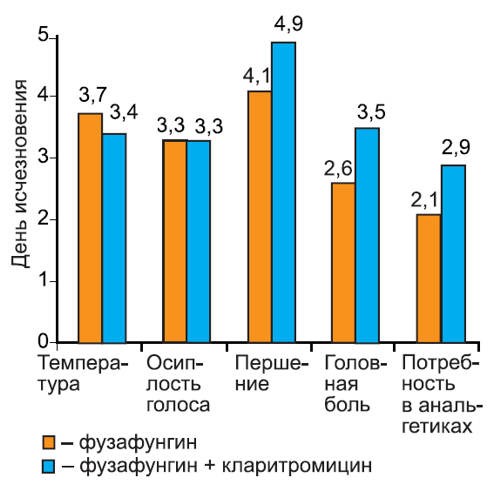
Рис. 3.Динамика исчезновения симптомов острого риносинусита.
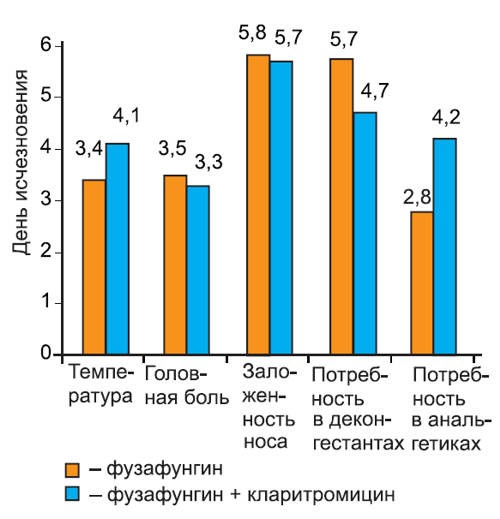
Рис. 4.Динамика исчезновения симптомов острого трахеобронхита.
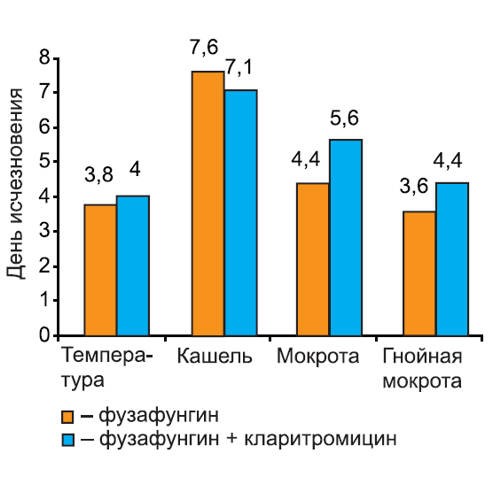
На графиках видно, что скорость исчезновения основных симптомов инфекции не различалась среди пациентов 1-й и 2-й групп. Более того, у пациентов с тонзиллитом/фарингитом и риносинуситом, получавших кларитромицин, дольше сохранялась потребность в анальгетиках (в среднем на 1 сут, различия недостоверны). Это можно объяснить более длительным сохранением головной боли на фоне кларитромицина, так как реакции со стороны центральной нервной системы являются характерным нежелательным явлением при применении некоторых макролидных антибиотиков. В то же время у пациентов с риносинуситом отмечено более быстрое прекращение использования сосудосуживающих препаратов, хотя различия между группами были также недостоверны.
Представленные данные показывают, что присоединение макролидного антибиотика к фузафунгину не приводит к более быстрому исчезновению симптомов заболевания.
Нежелательные явления в процессе лечения зарегистрированы у 2 пациентов 1-й группы и 5 пациентов 2-й группы, из них у 1 пациента 1-й группы (3,8%) и 4 пациентов 2-й группы (16%) эти явления были расценены как вероятно связанные с проводимой терапией. У пациента 1-й группы на фоне применения фузафунгина побочный эффект характеризовался чиханием после ингаляции препарата, такой же побочный эффект отмечен и у пациента 2-й группы, что можно также связать с действием фузафунгина. У 3 пациентов 2-й группы отмечены также явления со стороны желудочно-кишечного тракта (у 2 - тошнота и у 1 - боли в эпигастрии), что, скорее всего, связаны с приемом кларитромицина, так как являются характерными побочными эффектами для данного антибиотика. Ни в одном случае не потребовалось досрочного прекращения лечения.
Таким образом, в группе пациентов, получавших комбинированную терапию, побочные эффекты наблюдались несколько чаще.
Заключение
- Широкое использование системных антибиотиков в амбулаторной практике способствует росту резистентности.
- При многих острых неосложненных инфекциях верхних дыхательных путей назначение системных антибиотиков не улучшает результатов лечения.
- Ограничительная политика применения системных антибиотиков способствует снижению резистентности в популяции.
- В современных условиях возрастает значение местных антибиотиков для лечения острых инфекций верхних дыхательных путей (кроме стрептококкового фарингита), таких как фузафунгин.
- Результаты проведенных исследований свидетельствуют о высокой клинической и бактериологической эффективности фузафунгина в режиме монотерапии при острых бактериальных респираторных инфекциях; присоединение макролидного антибиотика к фузафунгину при нестрептококковых инфекциях верхних дыхательных путей не приводит к повышению эффективности лечения или ускорению выздоровления больных, но сопровождается увеличением частоты побочных эффектов.
- McCaig LF, Hughes JM. Trends in antimicrobial drug prescribing among office-based physicians in the United States. JAMA 1995; 273: 214-9.
- Ball P, Baquero F, Cars O et al. Antibiotic therapy of community respiratory tract infections: strategies for optimal outcomes and minimized resistance emergence. J Antimicrob Chemother 2002; 49 (1): 31-40.
- Schlemmer B. Impact of registration procedures on antibiotic polices. Clin Microbiol Infect Dis 2001; 7 (Suppl. 6): 5-8.
- Gonzales R, Bartlett JG, Besser RE et al. Principles of appropriate antibiotic use for treatment of acute respiratory tract infections in adults: background, specific aims, and methods. Ann Intern Med 2001; 134 (6): 479-86.
- Snow V, Gonzales R. Principles of appropriate antibiotic use for treatment of nonspecific upper respiratory tract infections in adults. Ann Intern Med 2001; 134 (6): 487-9.
- Gonzales R, Steiner JF, Sande MA. Antibiotic prescribing for adults with colds, upper respiratory tract infection, and bronchitis by ambulatory care physicians. JAMA 1997; 278: 901-4.
- Hickner JM, Bartlett JG, Besser RE et al. Principles of appropriate antibiotic use for acute rhinosinusitis in adults: background. Ann Intern Med 2001; 134 (6): 498-505.
- Williams JW, Aguilar C, Makela M et al. Antibiotic therapy for acute sinusitis: a systematic literature review. Eds. R.Douglas, C.Bridges-Webb. Acute Respiratory Infections Module of the Cochrane Database of Systematic reviews. The cochrane Library. Oxford: Updated Software; 1997.
- Zucher DR, Balk E, Engels E et al. Agency for Health Care Policy and Research Publication N.99-E016: Evidence Report/Technology Assessment Number 9. Diagnosos and treatment of acute bacterial rhinosinusitis.
- Low DE. Antimicrobial drug use and resistance among respiratory pathogens in the community. Clin Infect Dis 2001; 33 (Suppl. 3): S206-13.
- Guillemot D. How to evaluate and predict the epidemiologic impact of antibiotic use in humans: the pharmacoepidemiologic approach. Clin Microbiol Infect 2001; 7 (Suppl. 5): 19-23.
- Perez-Trallero E. Pneumococcal macrolide resistance - not a myth. J Antimicrob Chemother 2000; 45: 401-2.
- Dagan R, Piglansky L, Yagupsky P et al. Bacteriologic response in acute otitis media: comparison between azithromycin, cefaclor, amoxicillin [abstract K-103]. In Program and Abstract of the 37th Interscience Conference on Antimicrobial Agents and chemotherapy. Sep. 28 - Oct. 1, 1997, Toronto, Canada.
- Jacobs MR, Dagan R, Rose FV et al. Correlation of bacteriologic outcome and antimicrobial susceptibility of Streptococcus pneumoniae and Haemophilus influenzae in acute otitis media treated with amoxicillin-clavulanate and azithromycin [abstract 164]. 39th Interscience Conference on Antimicrobial Agents and Chemotherapy. September 1999; 707.
- Сидоренко С.В. Яковлев С.В. Инфекции в интенсивной терапии. 2-е изд. М. Бионика, 2003; 208.
- Baquero F. Pneumococcal resistance to beta-lactam antibiotics: a global geographic overview. Microb Drug Resist 1995; 1: 115-20.
- Guillemot D, Carbon C, Thibult N et al. Macrolide use is associated with macrolide resistant (MRSp) and penicillin resistant (PRSp) Streptococcus pneumoniae. 40th ICAAC. Toronto: ASM 2000; 1863: 1.
- Bryskier A. Viridans group Streptococci: a reservoir of resistant bacteria in oral cavities. Clin Microbiol Infect 2002; 8: 65-9.
- Fujita K, Murono K, Yoshikawa M, Murai T. Decline of erythromycin resistance of group A Streptococci in Japan. Pediatr Infect Dis J 1994; 13: 1075-8.
- Seppala H, Klaukka T, Vuopio-Varkila J et al. The effect of changes in the consumption of macrolide antibiotics on erythromycin resistance in group A Streptococci in Finland. N Engl J Med 1997; 337: 441-6.
- Dowell SF (ed.). Principles of judicious use of antimicrobial agents for children's upper respiratory tract infections. Pediatrics 1998; 1.
- Snow V, Mottur-Pilson C, Hickner JM. Principles of appropriate antibiotic use for acute sinusitis in adults. Ann Intern Med 2001; 134 (6): 495-7.
- Snow V, Mottur-Pilson C, Cooper RJ, Hoffman JR. Principles of appropriate antibiotic use for acute pharyngitis in adults. Ann Int Med 2001; 134 (6): 506-8.
- Lund VJ, Grouin JM, Eccles R et al. Efficacy of fusafungine in acute rhinopharingitis: a pooled analysis. Rhinology 2004; 43: 207-12.
- Mosges R, Spaeth J, Berger K, Dubois F. Topical treatment of rhinosinusitis with fusafungine nasal spray. Arzneim.-Forsch. Drug Res 2002; 52 (12): 877-83.
- German-Fattal M, Mosges R. How to improve current therapeutic standarts in upper respiratory infections: value of fusafungine. Curr Med Res Opin 2004; 20 (11): 1769-76.
