АНЕВРИЗМЫ СОСУДОВ ГОЛОВНОГО МОЗГА
Аневризма сосудов головного мозга (синоним – внутричерепная аневризма) – патологическое состояние, характеризующееся наличием образования на одном или нескольких сосудах головного мозга, которое достаточно быстро растёт и наполняется кровью. В зависимости от размера аневризм можно делать предположительный дальнейший прогноз, так, совсем малые аневризмы не приведут к кровоизлиянию, а более крупные могут стать причиной довольно тяжёлых осложнений. Аневризма может образоваться в любом месте, однако излюбленной её локализацией считается места разветвления артерий. Различают 2 основных типов аневризм:
Артериовенозная аневризма характеризуется расширением венозных сосудов головного мозга. Основные клинические симптомы данной формы указывают на недостаточность мозгового кровоснабжения и кровообращения, которая проявляется в виде интенсивных головных болей, парестезий (нарушение чувствительности), эпилептических припадков, нарушения двигательной функции.
Артериальная аневризма представляет собой специфическое мешковидное, порой сферическое выпячивание стенки артериального сосуда. Аневризма сосудов головного мозга является следствием изменения в строении сосудистой стенки, которая в норме имеет 3 слоя: внутренний — интиму, мышечный слой и наружный — адвентицию. Дегенеративные изменения, недоразвитие или повреждение одного или нескольких слоев сосудистой стенки приводят к истончению и потере эластичности пораженного участка стенки сосуда. В результате в ослабленном месте под давлением тока крови происходит выпячивание сосудистой стенки. Так образуется аневризма сосудов головного мозга. Наиболее часто аневризма сосудов головного мозга локализуется в местах разветвления артерий, поскольку там оказываемое на стенку сосуда давление наиболее высоко.
По некоторым данным аневризма сосудов головного мозга имеется у 5% населения. Однако зачастую она протекает бессимптомно. Увеличение аневризматического расширения сопровождается истончением его стенок и может привести к разрыву аневризмы и геморрагическому инсульту. Аневризма сосудов головного мозга имеет шейку, тело и купол. Шейка аневризмы подобно стенке сосуда характеризуется трехслойным строением. Купол состоит только из интимы и является наиболее слабым местом, в котором аневризма сосудов головного мозга может разорваться. Наиболее часто разрыв наблюдается у пациентов в возрасте 30-50 лет. По данным статистики именно разорвавшаяся аневризма сосудов головного мозга обуславливает до 85% нетравматических субарахноидальных кровоизлияний (САК).
Причины аневризмы сосудов головного мозга
Врожденная аневризма сосудов головного мозга является следствием аномалий развития, приводящих к нарушению нормального анатомического строения их стенки. Она часто сочетается с другой врожденной патологией: коарктацией аорты, дисплазией соединительной ткани, артерио-венозной мальформацией (АВМ) и т. п.
Приобретенная аневризма сосудов головного мозга может развиться в результате изменений, происходящих в стенке сосуда после перенесенной черепно-мозговой травмы, на фоне гипертензии при атеросклерозе и гиалинозе сосудов. В отдельных случаях она бывает вызвана заносом в мозговые артерии инфекционных эмболов. Такая аневризма сосудов головного мозга в неврологии носит название микотической. Формированию аневризмы сосудов головного мозга способствуют такие гемодинамические факторы, как неравномерность кровотока и гипертензия.
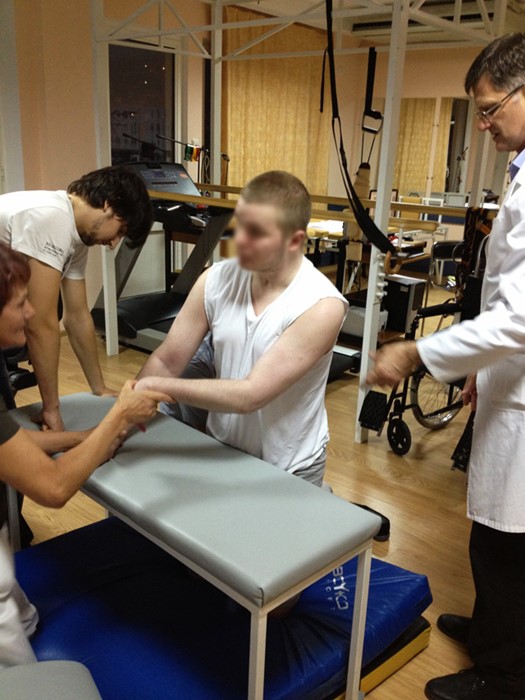
На фото: Пациент клиники «ВРЕМЕНА ГОДА», во время занятий
Диагноз – последствия перенесенного спонтанного разрыва аневризмы. Внутримозговое кровоизлияние.
Классификация и распространенность аневризмы сосудов головного мозга
По локализации аневризма сосудов головного мозга классифицируется на аневризму передней мозговой артерии, средней мозговой артерии, внутренней сонной артерии и вертебро-базилярной системы. В 13% случаях наблюдаются множественные аневризмы, располагающиеся на нескольких артериях.
По форме аневризма сосудов головного мозга чаше бывает мешотчатая, реже веретенообразная, мешотчатая аневризма сосудов головного мозга может быть одно- или многокамерной.
Существует также классификация аневризмы сосудов головного мозга по величине, согласно которой выделяют милиарные аневризмы размером до 3 мм, малые — до 10 мм, средние — 11-15 мм, большие — 16-25 мм и гигантские — более 25 мм.
Врожденные аневризмы встречаются достаточно часто от 1 до 5%. К счастью 50–80% аневризм не подвержены разрыву. Частота субарахноидальных кровоизлияний (СК) вследствие разрыва аневризмы составляет примерно 1:10000, которые чаще наблюдаются у женщин, чем у мужчин (2:1) достигая максимума в возрасте 55–60 лет.
С разрывом внутричерепных аневризм связывают 5–15% инсультов. Смертность к 30 дню от момента возникновения геморрагического инсульта достигает 45%, а 30% выживших становятся инвалидами, требующими нейрореабилитации, в условиях специализированной клиники. Клиника «Времена года» в Ялте располагает современными технологиями, позволяющими восстанавливать утраченные функции, после кровоизлияний, вызванных разрывом аневризм.
Причины, способствующие появлению, росту и разрыву аневризм, изучены достаточно плохо; по–видимому, ключевую роль играют артериальная гипертония и спровоцированные курением изменения сосудистой стенки. Гистологически выявляется истончение tunica media (средней оболочки артерии). В комбинации с гемодинамическими изменениями структурные дефекты вызывают локальное аневризматическое расширение участка артерии, которое «выпячивается» в субарахноидальное пространство в области основания мозга.
Клинические проявления
По своим клиническим проявлениям аневризма сосудов головного мозга может иметь тумороидное или апоплексическое течение.
При тумороидном варианте аневризма сосудов головного мозга прогрессивно увеличивается и, достигая значительных размеров, начинает сдавливать расположенные рядом с ней анатомические образования головного мозга, что приводит к появлению соответствующих клинических симптомов. Опухолевидная аневризма сосудов головного мозга характеризуется клинической картиной внутричерепной опухоли. Ее симптомы зависят от места расположения.
Наиболее часто опухолеподобная аневризма сосудов головного мозга выявляется в области зрительного перекреста (хиазмы) и в кавернозном синусе.
Аневризмы внутренней сонной артерии подразделяются на следующие группы:
- аневризмы в кавернозном синусе (инфраклиновидные - расположенные ниже клиновидных отростков турецкого седла),
- аневризмы супраклиновидной части артерии,
- аневризмы вблизи бифуркации сонной артерии.
Аневризмы в пределах кавернозного синуса: в зависимости от различной локализации выделяют три синдрома кавернозного синуса - задний, для которого характерно поражение всех ветвей тройничного нерва в сочетании с глазодвигательными нарушениями; средний - поражение I и II ветвей тройничного нерва и глазодвигательные расстройства; передний - боль и нарушение чувствительности в зоне иннервации I ветви тройничного нерва и паралич II, IV и VI нервов.
Большие и длительно существующие аневризмы сонной артерии в кавернозном синусе могут вызывать деструктивные изменения костей черепа, видимые на рентгенограмме.
При разрыве аневризм в кавернозном синусе не бывает кровоизлияния в полость черепа вследствие экстрадурального их расположения. Аневризмы супраклиновидной части внутренней сонной артерии располагаются вблизи отхождения задней соединительной артерии и характеризуется, помимо типичных для всех симптомов субарахноидального кровоизлияния, избирательным поражением глазодвигательного нерва в сочетании с локальной болью в лобно-глазничной области.
Аневризмы бифуркации сонной артерии нередко вызывают нарушения зрения из-за их расположения в наружном углу хиазмы.
Аневризмы передней мозговой артерии характеризуются нарушениями психики, парезами ног, гемипарезами с экстрапирамидными изменениями тонуса в руке, что объясняется спазмом передних мозговых артерий и их ветвей.
Аневризмы средней мозговой артерии при разрыве обусловливают развитие пареза противоположных конечностей, речевых нарушений, реже расстройств чувствительности.
Аневризмы вертебробазилярной системы обычно протекают с симптомами поражения образований задней черепной ямки (дизартрия, дисфагия, нистагм, атаксия, парез VII и V нервов, альтернирующие синдромы).
Множественные аневризмы составляют около 15% всех аневризм. Особенности клинического течения определяются локализацией той аневризмы, из которой произошло кровоизлияние.
Артериовенозные аневризмы (артериовенозные ангиомы, сосудистые мальформации, или пороки развития) также могут быть причиной внутричерепных кровоизлияний. Это сосудистые клубки различного размера, образованные беспорядочным переплетением извитых и расширенных вен и артерий. Размер их колеблется от нескольких мм до гигантских образований, занимающих большую часть полушария мозга. Чаще всего они локализуются в лобно-теменных отделах. Артериовенозные аневризмы являются врожденной аномалией мозговых сосудов. Характерная особенность строения этих аневризм - отсутствие в них капилляров, что ведет к прямому шунтированию артериальной и венозной крови. Основные клинические симптомы артериовенозных аневризм - внутримозговые кровоизлияния и эпилептиформные припадки.
Разрыв аневризмы
Первым симптомом разрыва аневризмы является внезапная очень интенсивная головная боль. Вначале она может носить локальный характер, соответствующий месту расположения аневризмы, затем становится диффузной. Головная боль сопровождается тошнотой и многократно повторяющейся рвотой. Возникают менингеальные симптомы: гиперестезия, ригидность затылочных мышц, симптомы Брудзинского и Кернига. Затем происходит потеря сознания, которая может длиться различный период времени. Могут наблюдаться эпилептиформные приступы и психические расстройства от небольшой спутанности сознания до психозов.
Субарахноидальное кровоизлияние, возникающее при разрыве аневризмы сосудов головного мозга, сопровождается длительным спазмом расположенных вблизи аневризмы артерий. Примерно в 65% случаев этот сосудистый спазм приводит к поражению вещества головного мозга и развитию ишемического инсульта.
Помимо субарахноидального кровоизлияния разорвавшаяся аневризма сосудов головного мозга может вызвать кровоизлияние в вещество или желудочки головного мозга. Внутримозговое кровоизлияние наблюдается в 22% случаев разрыва аневризмы.
Кроме общемозговой симптоматики она проявляется нарастающей очаговой симптоматикой, зависящей от локализации гематомы. В 14% случаев разорвавшаяся аневризма сосудов головного мозга становиться причиной кровоизлияния в желудочки.

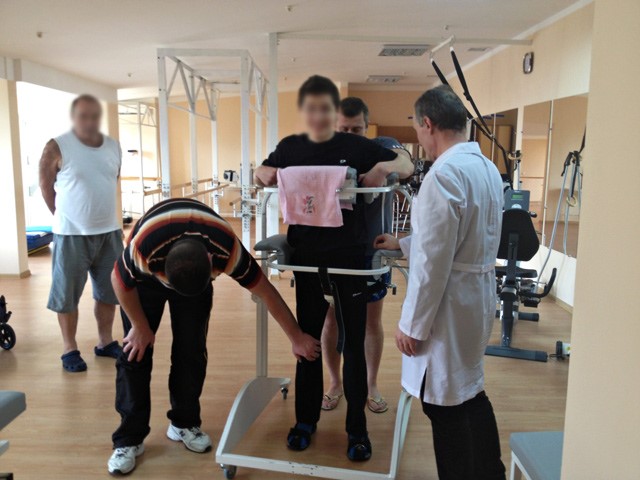
На фото: Пациент во время занятий. Диагноз спонтанный разрыв аневризмы. Массивное внутримозговое кровоизлияние
Клиническое течение аневризм и риск разрыва
Наиболее часто ВА манифестируют при разрывах, чтопроявляется симптомами СК. В настоящее время благодаря большей доступности высокочувствительных неинвазивных методов визуализации аневризмы можно диагностировать и до разрыва. Неразорвавшаяся аневризма может протекать бессимптомно, и обнаруживают ее при случайном обследовании, или же она вызывает развитие клинической симптоматики, обусловленной наличием объемного образования в полости черепа (паралич черепных нервов или признаки сдавления ствола мозга). Одним из характерных симптомов является внезапный паралич III пары черепных нервов, возникающий на фоне увеличения размеров аневризмы задней соединительной артерии.
СК вследствие разрыва аневризм зачастую рецидивируют. В 2–4% случаев повторное кровоизлияние происходит в первые 24 часа, а в 15–20% – в первые две недели. При наличии неврологической симптоматики (паралич черепных нервов, нарушение деятельности ствола мозга) риск разрыва аневризмы особенно велик (до 6% в год), поэтому таких пациентов необходимо регулярно обследовать и лечить. Риск разрыва случайно обнаруженной ВА, из которой не было кровотечения, существенно ниже, поэтому они не требуют непрерывного наблюдения.
Раньше считалось, что для любой внутричерепной аневризмы характерен высокий риск разрыва 1–2% в год. До появления микроспиралей для предотвращения разрыва ВА в большинстве случаев предпочитали клипировать хирургическим путем.
Но после опубликования результатов ретроспективного исследования, проведенного на базе 53 медицинских учреждений и включившего анализ историй болезни 2621 пациента, традиционные представления о риске разрыва ВА изменились. Выяснилось, что в когорте больных с неразорвавшимися аневризмами, отобранными для консервативного лечения, частота разрывов небольших аневризм не превышала 0,05% в год. Среди пациентов с анамнестическими кровотечениями из аневризмы риск кровоизлияния оказался в 10 раз выше по сравнению с испытуемыми без кровотечений в анамнезе. Риск разрыва крупных аневризм (более 10 мм в диаметре), аневризм сосудов основания мозга и аневризм задней соединительной артерии еще больше.
Аналогичные данные были получены при проведении исследования (Международное исследование по неразорвавшимся ВА), в котором было задействовано 1692 пациента, отобранных для консервативной терапии. Однако стратификация носила несколько иной характер: за пятилетний срок наблюдений разрывов небольших аневризм – а больных с такими аневризмами оказалось 62% – вообще не было. Дальнейшие испытания выявили больший риск разрыва ВА.
Клиническая картина, диагностика и тактика лечения субарахноидальных кровоизлияний (СК)
В большинстве случаев при СК возникают внезапные необычайно интенсивные головные боли, описываемые пациентом, как «сильнейшая головная боль в моей жизни». Однако еще до начала лечения около 10% больных погибают, многие впадают в кому, у других развивается тяжелая неврологическая симптоматика. Неврологический статус оценивается по специальным критериям, которые позволяют достаточно точно спрогнозировать исход, например, по классификации Ханта и Хесса.
При подозрении на СК диагностическим методом выбора остается компьютерная томография (КТ) без введения контрастного вещества. При проведении КТ без контрастного усиления объем кровопотери оценивается по 4–балльной шкале Фишера. В 5% случаев, когда КТ не выявляет патологических изменений, выполняется люмбальная пункция, даже несмотря на симптомы СК. Наличие примеси крови в спинномозговой жидкости, которая не осаждается при отстаивании, может свидетельствовать о СК. Ксантохромия (желтоватое окрашивание спинномозговой жидкости), обусловленная разрушением гемоглобина и появлением билирубина, даже более патогномонична, чем наличие крови. Если СК произошло более чем за 12 часов до проведения люмбальной пункции, то будет наблюдаться ксантохромия спинномозговой жидкости, в то время как при свежем кровотечении (например, в случае повреждения сосуда иглой для люмбальной пункции) ксантохромия отсутствует.
После окончательной постановки диагноза СК необходимо определить, стал ли его причиной именно разрыв аневризмы. Для этого выбирают наиболее подходящий для данного конкретного случая метод визуализации. Методы и режимы визуализации для выявления ВА, оценки их размеров и морфологических особенностей используют КТ ангиографию (КТА) с внутривенным введением контраста, магнитно–резонансную ангиографию (МРА), ангиографию с прямой катетеризацией артерии (катетеризационная ангиография), которая до сих пор считается точкой отсчета. В ряде исследований проводилось сравнительное изучение диагностических возможностей КТА, МРА, КТА + МРА и катетеризационной ангиографии и/или интраоперационной визуализации ВА.
Клинические аспекты визуализации
Катетеризационная ангиография высокого разрешения обладает большой точностью, а потому является методом выбора для диагностики СК, хотя раньше таким методом считалась КТА. Для диагностики неразорвавшихся аневризм на первом этапе рекомендуется использовать малоинвазивные КТА и МРА. При наличии СК в 10–20% случаев с помощью ангиографии аневризму обнаружить не удается. Если ангиография дала отрицательные результаты, то через 1–6 недель исследование повторяют. Этиология СК при отсутствии верифицированной аневризмы неизвестна. Одним из гипотетических механизмов может быть разрыв мелкой артерии или вены, вызванный резким подъемом давления. Для исключения тромбоза аневризмы, кровотечения из опухоли, артерио–венозных мальформаций спинного мозга и дуральных артерио–венозных фистул при первом посещении врача проводится МРТ головного и шейного отдела спинного мозга с контрастным усилением, хотя в этих случаях ее диагностическая ценность невелика.
Непосредственные исходы субарахноидальных кровоизлияний
У 15–20% пациентов на фоне СК развивается гидроцефалия. Тактика лечения при симптоматической гидроцефалии – вентрикулостомия с шунтированием спинномозговой жидкости. Церебральный ангиоспазм – основная причина смертности и инвалидизации пациентов с СК – представляет собой сужение просвета внутричерепных кровеносных сосудов, которое происходит в сроки от 3 до 12 дней с момента кровоизлияния. Причина такого ангиоспазма неизвестна; даже при проведении активной терапии он может спровоцировать инсульт и летальный исход. Диагностировать ангиоспазм помогает неинвазивная транскраниальная допплерография.
Консервативная терапия
Основу медикаментозного лечения составляет нимодипин в таблетках (60 мг каждые 4 часа в течение 21 дня); применение этого препарата улучшает исходы СК. При повышении кровотока в сосудах головного мозга по данным транскраниальной допплерографии или в случае нарастания неврологического дефицита с появлением новой симптоматики начинают так называемую «три–Г терапию» (гипертония, гиперволемия, гемодилюция). Ее задачи – обеспечить поддержание гематокрита на уровне 30% и центрального венозного давления на уровне 8–12 мм рт.ст. а также создать искусственную гипертонию с целью предотвратить или купировать неврологическую симптоматику. Выраженность неврологического дефицита зачастую зависит от того, бассейн какой артерии пострадал в результате ангиоспазма, и варьирует от незначительного снижения уровня активности до развития гемипарезов. С учетом возможных осложнений три–Г терапии (в частности, нарушения сердечной деятельности) для подтверждения результатов транскраниальной допплерографии может потребоваться катетеризационная ангиография. Если вновь возникшая неврологическая симптоматика сохраняется достаточно длительно, а ответа на лечение нет, для верификации ангиоспазма срочно проводят катетеризационную ангиографию, после чего выполняют ангиопластику спазмированных сосудов или внутриартериальное введение гладкомышечных спазмолитиков, таких как папаверин. В подавляющем большинстве случаев (90–98%) баллонная ангиопластика и введение спазмолитиков способствуют расширению просвета артерии, визуализируемому ангиографически. Однако результаты радиографии не всегда коррелируют с улучшением клинической картины. По некоторым данным, неврологический статус улучшается у 61–70% больных, в то время как другие данные свидетельствуют об отсутствии преимуществ такой тактики лечения по сравнению с три–Г терапией.
Нарушение сердечной деятельности после СК встречается достаточно часто и проявляется изменениями на электрокардиограмме (25–100%) повышением уровня сердечных ферментов (тропонина – в 17–28% случаев, МВ–изофермента креатинкиназы – в 37% случаев), а также дисфункцией левого желудочка (8–30%). Возникновение этих симптомов, в совокупности получивших название «оглушенного» миокарда, обусловлено мощным выбросом катехоламинов в ответ на СК. Верифицировать диагноз позволяет резкое снижение фракции выброса в сочетании с ухудшением сократительной способности стенок желудочка, не соответствующее по своей выраженности признакам сосудистой ишемии по данным электрокардиографии. Содержание МВ–изофермента креатинкиназы и тропонина обычно повышено, однако по сравнению с истинной ишемией миокарда уровень тропонина в 10 раз ниже. У большинства пациентов состояние «оглушения» миокрада носит транзиторный характер, некроз сердечной мышцы происходит редко и не зависит от сроков начала лечения.
Тактика ведения
Существует три подхода к тактике ведения больных с внутричерепными аневризмами: динамическое наблюдение, трепанация черепа с наложением клипсы (клипирование) и эндовазальная окклюзия аневризмы микроспиралями (эмболизация). При разрыве аневризмы (I–IV степень по классификации Ханта и Хесса) оперативное лечение проводят как можно раньше, желательно в первые 72 часа. Единого мнения о том, как вести наиболее тяжелых пациентов (V степень по классификации Ханта и Хесса), нет. Поскольку клинический опыт свидетельствует о высокой частоте неблагоприятных исходов, несмотря на лечение, таких пациентов предлагают вести консервативно до наступления клинического улучшения. Однако результаты недавних исследований говорят в пользу активной тактики ведения большинства больных и выполнения, например, дренирования желудочков или окклюзии аневризмы путем клипирования или эмболизации. В таких ситуациях, когда ткань головного мозга уже значительно пострадала, более физиологичным считается использование микроспиралей, а не клипс.
Бессимптомные аневризмы, аневризмы, обнаруженные при случайном обследовании, наблюдают в динамике или оперируют выборочно в зависимости от желания пациента, а также размера и состояния аневризмы. Динамическое наблюдение подразумевает периодические осмотры лечащего врача и проведение обследования с использованием одного из методов визуализации. Трепанация черепа и клипирование аневризмы проводится под общей анестезией в условиях нейрохирургической операционной. Постоянную клипсу, изготовленную из немагнитного материала, накладывают поперек шейки аневризмы, выключая ее, таким образом, из циркуляции. Эндоваскулярную эмболизацию осуществляет интервенционный нейрорадиолог, нейрохирург или невролог, получивший специальную подготовку по интервенционной радиологии. Операцию обычно выполняют под наркозом, хотя в некоторых медицинских учреждениях предпочитают вводить только седативные препараты, что позволяет контролировать неврологический статус пациента в ходе процедуры. Еще одна возможность отследить изменения в неврологическом статусе при проведении эмболизации – нейрофизиологический мониторинг. Под контролем ангиографии к зоне локализации аневризмы подводят микрокатетер, через который в полость аневризмы вводят микроспирали различных размеров и формы, ограничивая или прекращая поступление в нее крови.
Сравнение клипирования и эмболизация
Осложнения клипирования
Согласно результатам крупного одноцентрового исследования и данным мета–анализа, показатели заболеваемости и смертности, ассоциированных с клипированием неразорвавшихся аневризм, составляют 4,0–10,9 и 1,0–3,0, соответственно. Хотя успешно выполненное клипирование практически исключает вероятность разрыва аневризмы, всегда остается незначительный риск возникновения технических трудностей, неполного закрытия просвета шейки аневризмы (5,2%), ее рецидива (1,5%) и кровотечения (0,26%), о чем свидетельствуют длительные наблюдения. В ходе международного исследования по неразорвавшимся ВА оценивался риск осложнений, связанных с хирургическим клипированием неразорвавшихся аневризм. Он составил 15,7%, что превышает результаты более ранних исследований. Однако согласно данным другого одноцентрового исследования, значения этого показателя составили 3–7%. Как бы то ни было, результаты международного исследования по неразорвавшимся внутричерепным аневризмам в значительной степени изменили подходы к тактике ведения неразорвавшихся аневризм. Большинство пациентов с аневризмами теперь наблюдают в динамике. Рекомендации по тактике ведения неразорвавшихся внутричерепных аневризм сформулированы экспертами Комитета по инсультам Американской кардиологической ассоциации.
Осложнения эмболизации
Введение в полость аневризмы микроспиралей ассоциировано с развитием аллергических реакций на контрастный материал, появлением гематомы в паху и псевдоаневризм, инфицированием, то есть тех же самых осложнений, которые характерны для катетеризационной ангиографии, однако их риск минимален. Наиболее велика вероятность прободения стенки артерии (0,7%), окклюзии несущей артерии (2%) и тромбоэмболии (2,4%).
Одно из самых опасных осложнений – интраоперационный разрыв аневризмы в процессе подведения к ней катетера или установки микроспирали. Частота встречаемости этого осложнения составляет от 1,4 до 2,7%, а смертность достигает 30–40%. По данным другого исследовательского центра, риск интраоперационного разрыва аневризмы ниже (1%), при этом заболеваемость составляет 17%, а смертность – 0%. По–видимому, это объясняется все более широким внедрением технологии эмболизации в клиническую практику. В среднем же значения показателей интраоперационной заболеваемости и смертности в ходе проведения эмболизации находятся в пределах 3,7–5,3% и 1,1–1,5% соответственно. В 5–14,5% случаев осуществить эмболизацию не удается из–за чрезмерной извитости сосудов, что затрудняет доступ к аневризме, или из–за формы самой аневризмы.
Внедрение современных технологических новинок, в том числе микроспиралей, которые можно вводить в атипичные по морфологии аневризмы, баллонов и внутричерепных стентов, заметно снизило количество случаев, когда проведение эмболизации по стандартной методике невозможно. Следует отметить, что частичная окклюзия чаще происходит после эмболизации, чем хирургического клипирования. Согласно результатам трехцентрового исследования, к которому было привлечено 2868 пациентов с прооперированными, путем эмболизации, внутричерепными аневризмами, успешная окклюзия по данным ангиографии (закрытие аневризмы на 90–95% или визуализация только ее шейки) наблюдается в 85–90,4% случаев.
Окклюзия более крупных аневризм или аневризм с широкими шейками происходит менее успешно. Аневризмы, прооперированные с использованием микроспиралей, могут рецидировать, и в случае рецидива возникает опасность кровотечения. Со временем микроспираль сдавливается током крови внутри аневризмы. Этот процесс получил название компресии. В результате аневримзма вновь начинает заполняться кровью, т.е. происходит ее реканализация. Реканализация встречается в 20,9–33,6% случаев. Неизвестно, значима ли реканализация клинически; также непонятно, предотвращает ли реканализацию частичная эмболизация. Чтобы подтвердить факт реканализации аневризмы, проводят контрольную ангиографию, поскольку в этих ситуациях может быть показана повторная эмболизация, являющаяся достаточно безопасной процедурой. Таким образом, риск кровотечения из аневризмы, прооперированной с использованием микроспиралей, выше, чем из клипированной аневризмы, но все же остается очень низким.
Одним из перспективных решений проблемы реканализации аневризмы после эмболизации является применение биологически активных микроспиралей, импрегнированных соединениями, взаимодействующими с эндотелием сосудов и формирующими коллагеновую массу, которая закрывает вход в аневризму
Выбор оптимальной тактики лечения аневризм
Четких рекомендаций по выбору оптимальной тактики лечения разорвавшихся и неразорвавшихся ВА нет. Согласно сведениям научной литературы, необходимо принимать во внимание показания как к клипированию, так и к эмболизации. В некоторых случаях равнозначны оба метода, и тогда решение принимают с учетом, например, пожеланий пациента или опыта и квалификации хирурга.
Выбор тактики ведения конкретного пациента с ВА – динамическое наблюдение, хирургическое вмешательство на открытом черепе или эндоскопическая процедура – также активно дискутируется. Разорвавшуюся аневризму оперируют по экстренным показаниям, чтобы не допустить смертельно опасного рецидива кровотечения; в этом случае более целесообразна эмболизация, как менее инвазивный метод. Проводить хирургическое вмешательство по поводу ВА, выявленной при случайном обследовании, необязательно.
